
题目列表(包括答案和解析)
| 实验步骤 | 实验现象 | 实验结论 |
| a.取少量该溶液于一支试管中,加入 |
该氢氧化钠溶液已变质 | |
| b.将步骤a所得的液体静置,取上层清液于另一支试管中,滴加 |
该氢氧化钠溶液已部分变质 |
氢氧化钠固体及溶液在空气中很容易发生变质生成碳酸钠。
(1)甲同学在实验室里发现一瓶敞口放置的氢氧化钠溶液,对其变质情况进行了如下探究。
【猜想与假设】该氢氧化钠溶液已部分变质。
【实验与结论】
| 实验步骤 | 实验现象 | 实验结论 |
| a.取少量该溶液于一支试管中,加入 |
| 该氢氧化钠溶液已变质 |
| b.将步骤a所得的液体静置,取上层清液于另一支试管中,滴加 |
| 该氢氧化钠溶液已部分变质 |
【拓展探究】甲同学又尝试通过实验除去该氢氧化钠溶液中含有的碳酸钠,方案如下:
向该溶液中加入 ,充分反应后,经 操作,即可除去该氢氧化钠溶液中含有的杂质。
(2)乙同学在实验室里发现少量部分变质的氢氧化钠固体,尝试通过实验测定其中碳酸钠的质量分数。
【设计和进行实验】乙同学设计了下图所示的实验装置(铁架台、铁夹等固定用装置已略去,碱石灰是固体氢氧化钠和生石灰的混合物)。取10.0g待测样品,进行实验。
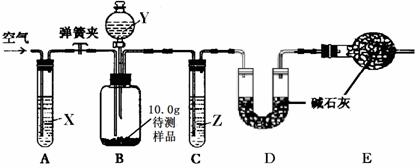
实验步骤如下:
a.连接好装置,并检查气密性;
b.打开弹簧夹,缓缓通入一段时间空气;
c.称量装置D的质量为83.4g;
d.关闭弹簧夹,慢慢滴加Y溶液,至不再产生气泡为止;
e.打开弹簧夹,再次缓缓通入一段时间空气;
f.再次称量装置D的质量为84.5g。
【交流讨论】
①试剂X、Y、Z依次最适宜选用 (选填字母)。
A.氢氧化钠溶液 浓盐酸 浓硫酸 B.澄清石灰水 稀盐酸 稀硫酸
C.氢氧化钠溶液 稀硫酸 浓硫酸 D.浓硫酸 稀硫酸 氢氧化钠溶液
②步骤e中通入空气的作用是 。
③若没有装置C,则会导致测定结果 (选填“偏大”、“偏小”或“无影响”,下同);若没有装置E,则会导致测定结果 。
【数据处理】根据实验中测得的有关数据,计算部分变质的氢氧化钠固体中碳酸钠的质量分数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com