37、某实验小组的四位同学在探究碱的性质时发现氢氧化钠、氢氧化钙等可溶性碱都能使酚酞试液变红.他们想进一步探究:不溶性的氢氧化镁是否也能使酚酞试液变红.为此,他们将适量的氢氧化镁加入到盛有热水的烧杯中搅拌,然后向浑浊的液体中滴加酚酞试液,发现酚酞试液变红,可是过一会儿红色又消失了.四位同学依据所学的化学知识,分别对上述酚酞试液变红、红色又消失的原因作了如下猜想:
小明:可能是个偶然现象.
小东:可能是浑浊液体中的固体氢氧化镁使酚酞试液变红,氢氧化镁沉降后溶液就变无色了.
小花:可能是酚酞试液与空气中的氧气反应,使红色消失;也可能是氢氧化镁溶液与空气中的二氧化碳反应的缘故.
小红:可能是在热水中氢氧化镁的溶解度大,溶液中OH一离子较多,使酚酞试液变红;过一会儿温度降低,氢氧化镁的溶解度减小,溶液中OH一离子变少,酚酞试液又变无色.
(1)对小明猜想“是个偶然现象”,四位同学都认为可以用科学探究的一般方法排除偶然现象.他们的方法是:
做重复实验.
.
(2)小花认为小东的猜想不正确,她从碱使酚酞试液变色的原因上给予了否定:
固体氢氧化镁中没有自由移动的OH-离子,不能使酚酞试液变红.
.
(3)四位同学讨论后认为要验证小花的猜想
还需做如下实验,你知道其实验的目的吗?
| 实验步骤 |
设计目的 |
将氢氧化镁加入到热水中搅拌,滴入酚
酞试液.并在上方滴一些植物油. |
|
(4)对小红的猜想,实验小组的同学设计了多种实验方案进行证明.请你写出其中一种.

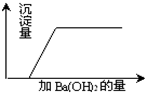 37、有一混合溶液是由硝酸、碳酸钠、硫酸、氯化铜四种物质中的两种混合而成,向该混合溶液中滴入Ba(OH)2溶液,产生沉淀的质量与加入 Ba(OH)2溶液体积的关系如图所示,据此回答:
37、有一混合溶液是由硝酸、碳酸钠、硫酸、氯化铜四种物质中的两种混合而成,向该混合溶液中滴入Ba(OH)2溶液,产生沉淀的质量与加入 Ba(OH)2溶液体积的关系如图所示,据此回答: