(2008?房山区一模)某中学化学学习小组在阅读了“除去织物上污渍的方法”后,发现草酸能够用于除去水果渍、血渍、铁锈、蓝墨水等污渍.对草酸产生了浓厚的兴趣.教师告诉同学们草酸的化学式为H
2C
2O
4,受热分解.同学们对草酸受热分解进行探究:
(1)提出问题:草酸受热分解的产物会是什么呢?
(2)查阅资料:①草酸晶体熔点较低,加热到182℃便开始熔化;
②无水硫酸铜为白色固体,易吸收水变成蓝色晶体,可用于检验水或作干燥剂;
③碱石灰是氢氧化钠和氧化钙两种固体的混合物,是常用的干燥剂,暴露在空气里,其氧化钙易与水反应,化学方程式为
CaO+H2O=Ca(OH)2
CaO+H2O=Ca(OH)2
.而氢氧化钠易与二氧化碳反应,化学方程式为
2NaOH+CO2═Na2CO3+H2O
2NaOH+CO2═Na2CO3+H2O
.
(3)猜想与假设:
第一种:草酸分解产物是CO
2和H
2;
第二种:草酸分解产物是CO
2、CO和H
2O;
第三种:草酸分解产物是CO
2和H
2O.
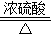
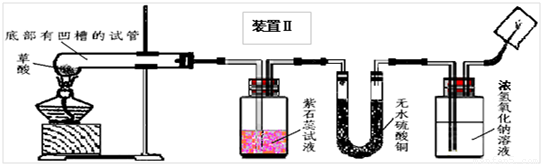
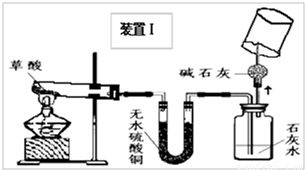
(4)实验装置的设计及实验:
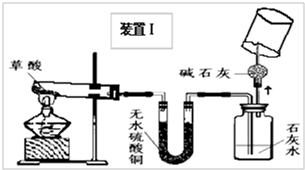
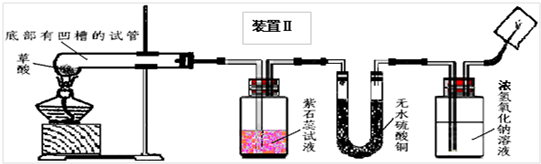
甲、乙同学分别设计了装置Ⅰ和装置Ⅱ.并分别用各自的装置进行了实验.
(5)实验记录:
甲同学实验观察到无水硫酸铜由白色变成蓝色,澄清石灰水变浑浊,且生成的气体通过碱石灰后,在尖嘴处点燃后能燃烧,在火焰上方罩一个内壁附有澄清石灰水的烧杯,澄清的石灰水变浑浊.
乙同学实验观察到紫石蕊试液变红,无水硫酸铜由白色变成蓝色,且生成的气体通过氢氧化钠溶液后,在尖嘴处点燃后能燃烧,在火焰上方罩一个内壁附有澄清石灰水的烧杯,澄清的石灰水变浑浊.
(6)结论:第2种猜想符合草酸分解实际,草酸受热分解的化学反应方程式为:
.
(7)反思与评价:实验之后,甲、乙同学相互交流各自的设计,并找到了不足.
A.在草酸受热分解装置设计上更科学的是装置
Ⅱ
Ⅱ
(填Ⅰ或Ⅱ).
B.在检验分解产物是否存在水的设计上,有漏洞的是装置
Ⅱ
Ⅱ
(填Ⅰ或Ⅱ).
C.在检验分解产物是否存在氢气的问题上,二者认为均被忽视了,但同时认为只要使用上
述装置
Ⅰ
Ⅰ
就可顺利完成实验证明,其操作方法是
在火焰上罩一干燥烧杯,观察,若内壁有水雾形成则有;反之没有
在火焰上罩一干燥烧杯,观察,若内壁有水雾形成则有;反之没有
.

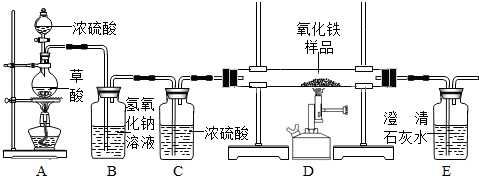
 CO↑+CO2↑+H2O.某化学课题组的同学欲用如下装置完成如下实验任务:
CO↑+CO2↑+H2O.某化学课题组的同学欲用如下装置完成如下实验任务: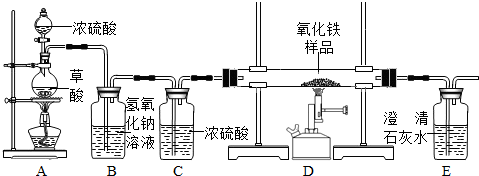
 CO↑+CO2↑+H2O.某化学课题组的同学欲用如下装置完成如下实验任务:
CO↑+CO2↑+H2O.某化学课题组的同学欲用如下装置完成如下实验任务: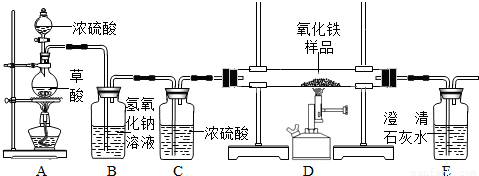
 (2008?房山区一模)某中学化学学习小组在阅读了“除去织物上污渍的方法”后,发现草酸能够用于除去水果渍、血渍、铁锈、蓝墨水等污渍.对草酸产生了浓厚的兴趣.教师告诉同学们草酸的化学式为H2C2O4,受热分解.同学们对草酸受热分解进行探究:
(2008?房山区一模)某中学化学学习小组在阅读了“除去织物上污渍的方法”后,发现草酸能够用于除去水果渍、血渍、铁锈、蓝墨水等污渍.对草酸产生了浓厚的兴趣.教师告诉同学们草酸的化学式为H2C2O4,受热分解.同学们对草酸受热分解进行探究: