
题目列表(包括答案和解析)
 某同学在帮助老师准备实验时,发现了一瓶失去标签的黑色粉末和一瓶标签破损的无色液体(如图).询问老师得知,该实验室的黑色粉末只有氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉五种可能.为了鉴定这两种试剂,该同学将黑色粉末与无色液体混合,发现立即产生气泡.
某同学在帮助老师准备实验时,发现了一瓶失去标签的黑色粉末和一瓶标签破损的无色液体(如图).询问老师得知,该实验室的黑色粉末只有氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉五种可能.为了鉴定这两种试剂,该同学将黑色粉末与无色液体混合,发现立即产生气泡.| 黑色粉末 | 无色液体 | |
| 猜测 | 二氧化锰 二氧化锰 |
双氧水 双氧水 |
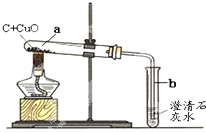 某研究性小组在实验室用如图实验装置做木炭还原氧化铜的实验.
某研究性小组在实验室用如图实验装置做木炭还原氧化铜的实验.| 实验方案 | 实验操作 | 实验现象 | 实验结论 |
方案Ⅰ | 取少量固体物质于试管中,加足量稀硫酸充分振荡 | 溶液变成蓝色 | 固体中________ |
方案Ⅱ |  玻璃管中是反应后固体,通入足量空气 | 澄清石灰水________ | 固体中不含木炭 |
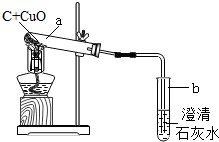 某研究性小组在实验室用如图实验装置做木炭还原氧化铜的实验.
某研究性小组在实验室用如图实验装置做木炭还原氧化铜的实验.
| ||
| ||
| 实验方案 | 实验操作 | 实验现象 | 实验结论 |
方案Ⅰ |
取少量固体物质于试管中,加足量稀硫酸充分振荡 | 溶液变成蓝色 | 固体中 氧化铜 氧化铜 |
方案Ⅱ |
 玻璃管中是反应后固体,通入足量空气 |
澄清石灰水 不变浑浊 不变浑浊 |
固体中不含木炭 |
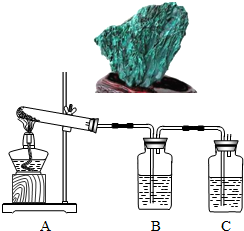 (2012?大兴区二模)孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理.
(2012?大兴区二模)孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理.
| ||
| ||
| 实验操作及现象 | 实验结论 |
| 该黑色粉末为氧化铜 |
| 配方l | 配方2 | 配方3 | 配方4 | |
| 木炭质量(g) | 0.4 | 0.5 | 0.6 | 0.7 |
| 氧化铜质量(g) | 8 | 8 | 8 | 8 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com