
题目列表(包括答案和解析)
| 浓度 时间(min) 条件 |
30% H2O2 | 15% H2O2 | 5% H2O2 |
| 加入a g MnO2 | 0.2 | 0.8 | 2.0 |
| 加入a g Fe2O3 | 7.0 | 9.0 | 16.0 |
| 阴离子 阳离子 | OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
| 实验步骤 | 实验现象 | 结论 |
| 在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液. | 没有白色沉淀产生 | 水垢中______. |
| 浓度 时间(min) 条件 | 30% H2O2 | 15% H2O2 | 5% H2O2 |
| 加入a g MnO2 | 0.2 | 0.8 | 2.0 |
| 加入a g Fe2O3 | 7.0 | 9.0 | 16.0 |
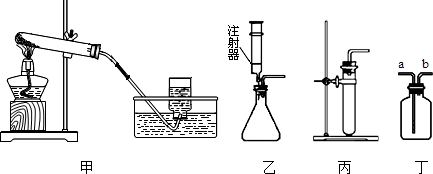
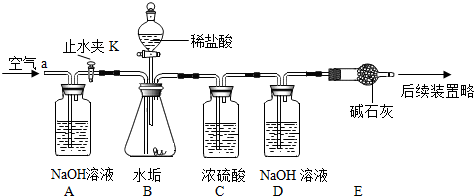
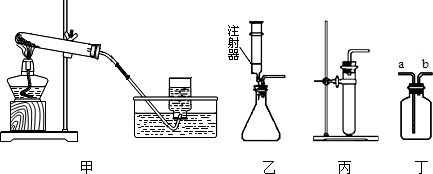
某校化学小组对热水壶底部水垢的主要成分进行了如下探究,请完成以下活动并回答相关问题。
【查阅资料】天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表(20℃):
| 阴离子 阳离子 | OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
| 实验步骤 | 实验现象 | 结论 |
| 在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液。 | 没有白色沉淀产生 | 水垢中 。 |

| 阴离子 阳离子 | OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
| 实验步骤 | 实验现象 | 结论 |
| 在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液. | 没有白色沉淀产生 | 水垢中______. |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com