
题目列表(包括答案和解析)

实验步骤如下:
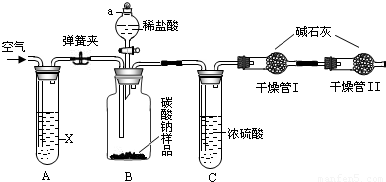
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;
③准确称得6.0g纯碱样品放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g。
试回答:
(1)鼓入空气的目的是_______________,装置A中试剂X最适宜选用_____________。
(2)若没有C装置,则会导致测定结果______________ (填“偏大”或“偏小”)。
(3)E装置的作用是 _________________。
(4)请根据实验中测得的有关数据,计算纯碱样品中碳酸钠的质量分数。(要求:写出计算过程,结果保留一位小数)

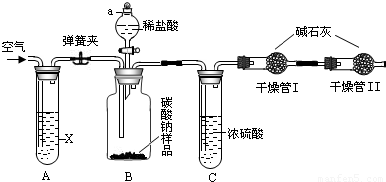
某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:①按图连接装置;②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为m1克;③准确称得m2克的纯碱样品放入容器b中;④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为m3克;⑥根据测得的数据分析计算碳酸钠的质量分数。试回答:
(1)在步骤①连接装置后还应 ;
(2)装置A中试剂可选用 ;
(3)写出装置B中的反应方程式 ;
(4)若没有C装置,则会导致测定结果 (填“偏大”或“偏小”);
(5)步骤⑤的目的是__ __;
(6)E装置的作用是__ __。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com