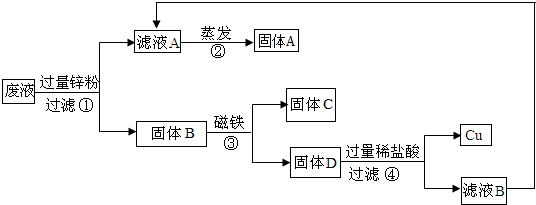
(2010?武清区二模)

今年春晚刘谦表演的近景魔术如真似幻,让人大饱眼福,陈老师也在化学晚会上表演如下魔术:用毛笔蘸取一种无色液体在一张白纸上书写了“中考必胜”四字,然后再喷上一种无色液体,白纸上立即出现了红色的“中考必胜”四字.你能揭底陈老师他先后所用的无色液体可能是
C
C
A.石蕊溶液、NaOH溶液 B.酚酞溶液、“雪碧”饮料
C.澄清石灰水、酚酞溶液 D.Fe
2(SO
4)
3溶液、NaOH溶液
碳酸钠俗称纯碱,其溶液能使无色酚酞变红,甲同学想探究是Na
+还是CO
32-的作用使酚酞试液变红,其设计方案如下:先往Na
2CO
3溶液中滴加酚酞试液后,再加入适量的Ca(OH)
2溶液,观察红色是否消失.资料查询:纯碱是一种盐,其溶液pH>7,氯化钙溶液pH=7.
①老师肯定了乙同学的看法,你认为甲同学方案的不合理之处是
Ca(OH)2溶液与Na2CO3溶液反应后的产物中含有能使无色酚酞试液变红的NaOH,干扰实验
Ca(OH)2溶液与Na2CO3溶液反应后的产物中含有能使无色酚酞试液变红的NaOH,干扰实验
;
②丙同学要证明是CO
32-的作用使酚酞试液变红.在下列物质中选用一种最好的试剂是(填序号)
C
C
;A.HCl B.NaOH C.CaCl
2③丁同学发现碳酸钠溶液碱性的强弱与溶液的浓度和温度有关,请你帮他完成实验探究.(只要求就一种影响碳酸钠溶液碱性强弱的因素设计实验方案.)
[实验方案]
在相同的温度下,取两份质量相等浓度不同Na2CO3溶液,分别用pH试纸测出其pH值进行比较,多测几次再下结论.或取两份质量相等的同种Na2CO3溶液,分别用pH试纸测出其在不同温度时pH值进行比较,多测几次再下结论
在相同的温度下,取两份质量相等浓度不同Na2CO3溶液,分别用pH试纸测出其pH值进行比较,多测几次再下结论.或取两份质量相等的同种Na2CO3溶液,分别用pH试纸测出其在不同温度时pH值进行比较,多测几次再下结论
.

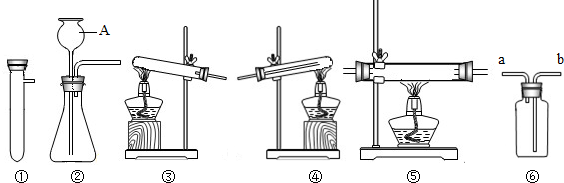


 B.
B. C.
C. D.
D.


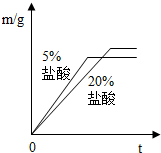 B.
B.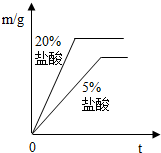
 D.
D.