
题目列表(包括答案和解析)
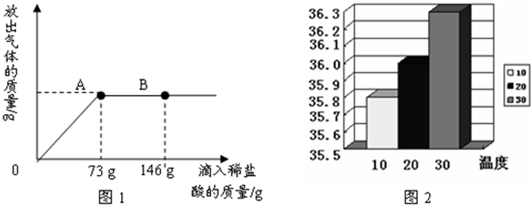
| ||
| ||
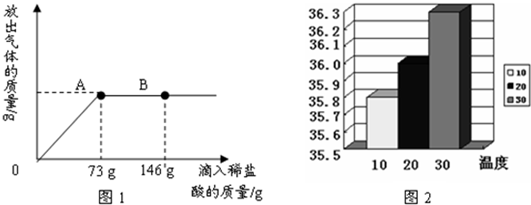
| 实验序号 | 试剂1 | 试剂2 | 混合的温度/℃ | 混合后最高或最低温度/℃ |
| ① | 35mL水 | 3.2g Na2CO3固体 | 20 | 24.3(t1) |
| ② | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20 | 25.1(t2) |
| ③ | 35mL水 | 2.5g NaHCO3固体 | 20 | 18.5(t3) |
| ④ | 35mL稀盐酸 | 2.5g NaHCO3固体 | 20 | 16.2(t4) |
下表是某实验报告中的一组数据:
| 实验序号 | 试剂1 | 试剂2 | 混合前 温度/℃ | 混合后最高或 最低温度/℃ |
| ① | 35mL水 | 3.2g Na2CO3固体 | 20 | 24.3(t1) |
| ② | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20 | 25.1(t2) |
| ③ | 35mL水 | 2.5gNaHCO3固体 | 20 | 18.5(t3) |
| ④ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20 | 16.2(t4) |
(1)从实验①、③数据可知:Na2CO3溶于水 热量,NaHCO3溶于水 热量。(填写“放出”或“吸收”)
(2)根据t2>t1可知:Na2CO3与稀盐酸反应 热量,根据t4<t3可知:NaHCO3与稀盐酸反应 热量。(填写“放出”或“吸收”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com