
题目列表(包括答案和解析)
碘酸钾(KIO3)主要用作食盐加碘剂
Ⅰ、制备碘酸钾
实验室制备碘酸钾的路线如下: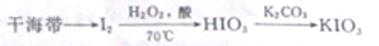
(1)KIO3中I的化合价为 ,含碘盐中的碘是指 (填字母)。
a、离子 b、元素 c、分子
(2)实验中需要用试纸测定溶液的PH,其操作方法是 。
(3)过滤操作需要的玻璃仪器有玻璃棒、烧杯和 。
(4)用冰水洗涤过滤所得KIO3晶体,其原因是 。
(5)温度过高,会造成H2O2利用率降低,可能的原因是 。
Ⅱ测定碘含量
资料:①碘酸钾与碘化钾反应方程式为:KIO3+5KI+3H2SO4===3K2SO4+3H2O+3I2
②淀粉溶液遇碘显色时,碘浓度越大颜色越深;
③扬州作为轻度缺碘地区,食盐中碘含量(以I计)应为18~33mg/Kg
步骤1:配置以下各种试剂:100g/L食盐溶液,2.14*10-3g/L KIO3溶液,测试液(含10g/L淀粉、196g/L H2SO4、1.66g/L KI)。
步骤2:取5支相同规格小试管,贴上编号标签,按下表要求分别依次加入步骤1中配置的KIO3溶液,测试液、蒸馏水,塞上橡皮塞,混合后有序放置在试管架上(各试管中KIO3完全反应)。
| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| KIO3溶液滴数 | 30 | 25 | 20 | 15 | 10 |
| 测试液滴数 | 10 | 10 | 10 | 10 | 10 |
| 蒸馏水滴数 | 0 | 5 | 10 | 15 | 20 |

| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| KIO3溶液滴数 | 30 | 25 | 20 | 15 | 10 |
| 测试液滴数 | 10 | 10 | 10 | 10 | 10 |
| 蒸馏水滴数 | 0 | 5 | 10 | 15 | 20 |
氯化钠是日常生活的必需品,也是重要的化工原料。
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是
粗盐提纯的操作流程。
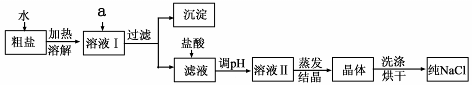
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、 、 ;
②在滤液中加盐酸的作用是 ;
(2)用提纯的NaCl配制200g0.9%的生 理盐水,需要NaCl的质量为 g。
理盐水,需要NaCl的质量为 g。
①配制该溶液时所需要的玻璃仪器有玻璃棒、 和 ,其中玻璃棒在该实验中所起的作用是________。
②如果配制后溶液溶质的质量分数低于 0.9%,你认为可能的原因是 。(任写一个)
0.9%,你认为可能的原因是 。(任写一个)
氯化钠是日常生活的必需品,也是重要的化工原料。
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。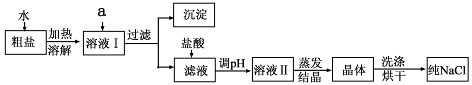
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、 、 ;
②在滤液中加盐酸的作用是 ;
(2)用提纯的NaCl配制200g0.9%的生理盐水,需要NaCl的质量为 g。
①配制该溶液时所需要的玻璃仪器有玻璃棒、 和 ,其中玻璃棒在该实验中所起的作用是_____ ___。
②如果配制后溶液溶质的质量分数低于0.9%,你认为可能的原因是 。(任写一个)
氯化钠是日常生活的必需品,也是重要的化工原料。
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。

提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、 、 ;
②在滤液中加盐酸的作用是 ;
(2)用提纯的NaCl配制200g0.9%的生理盐水,需要NaCl的质量为 g。
①配制该溶液时所需要的玻璃仪器有玻璃棒、 和 ,其中玻璃棒在该实验中所起的作用是_____ ___。
②如果配制后溶液溶质的质量分数低于0.9%,你认为可能的原因是 。(任写一个)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com