(1)请你参与下列探究:某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出.这一现象激发起同学们的探究欲望,生成的是什么气体?
【提出猜想】从元素守恒的角度,放出的气体可能是SO
2、O
2、H
2.
【查阅资料】SO
2易溶于水,它能与NaOH反应生成Na
2SO
3.
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
①甲同学认为是O
2,则检验方法是
用带火星的木条试验,木条复燃则是氧气
用带火星的木条试验,木条复燃则是氧气
.
②乙同学认为是SO
2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO
2与NaOH反应的化学方程式
SO2+2NaOH=Na2SO3+H2O
SO2+2NaOH=Na2SO3+H2O
.
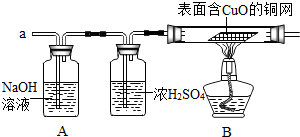
③实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体.
如果放出的是O
2和H
2,你认为方案中的安全隐患是
实验时在B处易发生爆炸事故
实验时在B处易发生爆炸事故
,
产生此隐患的原因:
(用方程式解释).
老师说:“化学反应中,一种元素的化合价升高,肯定有元素的化合价降低,这是科学规律”.丙同学根据老师这句话分析判断:放出的气体肯定不是
氧气
氧气
.
【实验探究】小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色,B装置的尾部有水珠生成;停止通气,再次称量装置A,发现质量无增减.
结论:铁粉与硫酸铜溶液反应时,产生的气体是
氢气
氢气
.
写出B装置中发生化学反应的方程式
.
(2)某同学模仿物理课上学到的“串联电路”设计了如下气体制取与性质验证的组合实验.打开分液漏斗活塞后,A中出现大量气泡,B中白磷燃烧,C中液面下降,稀盐酸逐渐进入D中,请看图回答问题.

①A中发生反应的化学方程式为
.
②B中白磷能够燃烧的原因是
与氧气接触
与氧气接触
.
③E中的实验现象是
溶液由紫色变红色
溶液由紫色变红色
.
④用F装置收集气体的依据是
气体密度比空气密度大
气体密度比空气密度大
.

 2Fe2O3
2Fe2O3 2H2↑+O2↑
2H2↑+O2↑ (1)请你参与下列探究:某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出.这一现象激发起同学们的探究欲望,生成的是什么气体?
(1)请你参与下列探究:某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出.这一现象激发起同学们的探究欲望,生成的是什么气体?