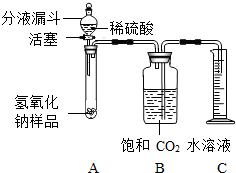
(2009?广元)某学生为测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已略去),实验在
27℃,l01kPa下进行,实验步骤如下:
①按图连接好装置;
②
检查装置气密性
检查装置气密性
;
③用天平准确称取氢氧化钠样品6g,放入A中试管内,向B中集气瓶内装满饱和二氧化碳水溶液;
④向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和二氧化碳水溶液220mL.
请回答下列问题:
(1)在实验步骤①~③之间,还缺少一个步骤,请将其补充在②后面的横线上.
(2)判断氢氧化钠发生变质的实验现象是
向氢氧化钠样品中滴加稀硫酸时产生气泡
向氢氧化钠样品中滴加稀硫酸时产生气泡
,氢氧化钠变质的原因是
2NaOH+CO2═Na2CO3+H2O
2NaOH+CO2═Na2CO3+H2O
(用化学方程式表示).
(3)B中集气瓶盛装的是饱和二氧化碳水溶液而不是水,其理由是
CO2能溶于水,而不溶于饱和的CO2水溶液中
CO2能溶于水,而不溶于饱和的CO2水溶液中
.
(4)判断步骤④中滴人的稀硫酸已过量的标志是
装置A中试管内没有气泡产生
装置A中试管内没有气泡产生
.
(5)氢氧化钠样品中碳酸钠的质量分数为
15.9%
15.9%
(27℃,l01kPa下二氧化碳的密度为l.8g/L,二氧化碳的体积等于排出的饱和二氧化碳水溶液的体积).
(6)要除去部分变质氢氧化钠中的碳酸钠,应将这种氢氧化钠样品溶于水配成溶液,然后向溶液中加适量的
Ba(OH)2
Ba(OH)2
,充分反应后过滤、蒸干滤液,就能得到比较纯净的氢氧化钠固体.反应方程式为
Ba(OH)2+Na2CO3═BaCO3↓+2NaOH
Ba(OH)2+Na2CO3═BaCO3↓+2NaOH
.

 某学生为测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已略去),实验在
某学生为测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已略去),实验在

 (2009?广元)某学生为测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已略去),实验在
(2009?广元)某学生为测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已略去),实验在