小王同学对化学充满了兴趣,喜欢做各种实验.有一次他和其它同学对镁进行了一些研究:
【Ⅰ】他们用砂纸打磨掉表面灰黑色的物质,将其放入水中,未看到有明显的现象,改用酒精灯加热后,观察到表面有大量气泡,经验是氢气.他们又向溶液中滴加无色酚酞试液,发现酚酞变成红色,说明有
OH-
OH-
产生.该实验表明化学反应的发生和速率与
温度
温度
有关,许多物质的
反应速度
反应速度
随温度的升高而增大.
【Ⅱ】该小组成员开始研究镁带表面的灰黑色物质,小王大胆提出了三个假设:
假设1该物质是MgO;假设2该物质是Mg(OH)
2;假设3镁可能会象铜一样生成碱式碳酸镁.
但其它同这立即否定了他的假设1和2,因为根据所学的知识MgO,Mg(OH)
2都是
白
白
色固体.对于假设3,他们设计了如下方案
| 实验方案 |
实验现象 |
实验结论 |
|
|
证明有CO32- |
| 取样于试管,加热 |
|
证明有氢元素 |
【III】他们在取镁带表面灰黑色样品时感到比较困难,索性将表面发黑的镁带全部磨成粉末,放入干燥的硬质试管中加热,一段时间后,镁粉突然出现红热燃烧起来,反应停止后有少量黑色物质A粘在试管壁上,这黑色物质A中混有什么?他们查资料筛选出几条有价值的信息:
(1)2Mg+CO
2=2MgO+C; (2)C+2H
2SO
4(浓)=CO
2↑+SO
2↑+H
2O;(3)SO
2+Ca(OH)
2=CaSO
3↓(白)+H
2O.
试分析A物质为
C
C
,根据上述信息,他们又设计了下列实验,帮助他们完成实验报告:
| 实验方案 |
实验现象 |
实验结论 |
| 取反应后试管内样品,先滴加过量的 稀硫酸 稀硫酸 |
固体部分溶解 |
|
| 再 加热 加热 (填一具体的实验操作) |
黑色固体全部溶解 |
|
【Ⅳ】为验证碳和浓硫酸反应的三种产物,应将气体通过下列三种试剂(假设每步均完全)即:
气体→
无水硫酸铜
无水硫酸铜
→
高锰酸钾溶液
高锰酸钾溶液
→
澄清石灰水
澄清石灰水
;
(现象依次为)
白色固体变蓝
白色固体变蓝
、
紫红色褪去
紫红色褪去
、
澄清石灰水变浑浊
澄清石灰水变浑浊
【V】该兴趣小组的同学进一步又查出胃药碱式碳酸镁有多种不同的组成,如Mg
2(OH)
2CO
3、Mg
4(OH)
2(CO
3)
3、Mg
5(OH)
2(CO
3)
4等.小红同学为确定碱式碳酸镁的组成,设计如图所示的实验:
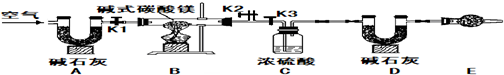
实验步骤(1)按图组装置后,首先进行的操作是
检查装置的气密性
检查装置的气密性
.E处干燥管内盛放的药品是
碱石灰
碱石灰
,其作用是
防止空气中的水蒸气进入装置
防止空气中的水蒸气进入装置
.
实验步骤(2)称取样品31g,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量为87.6g,装碱石灰的U型管D的质量为74.7g.
实验步骤(3)打开活塞
K1K2
K1K2
,关闭
K3
K3
,缓慢鼓入空气数分钟.
实验步骤(4)关闭活塞
K1K2
K1K2
,打开
K3
K3
,点燃酒精灯加热至不再产生气体为止.
实验步骤(5)打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,称得洗气瓶C的质量为89.4g,U型管D的质量为87.9g,则该碱式碳酸镁的化学式为
Mg4(OH)2CO3
Mg4(OH)2CO3
.
【Ⅵ】小明认为其化学式可用Mgx(OH)
2(CO
3)y表示,根据化合价规律,x和y的关系是
x=y+1
x=y+1
,写出该物质分解的方程式:
Mgx(OH)
2(CO
3)
yxMgO+H
2O+yCO
2↑
Mgx(OH)
2(CO
3)
yxMgO+H
2O+yCO
2↑
小明设计了两套方案(忽略装置中原来的气体)
方案I:只测定分解后生成的水,连接方案是A→C→B,则C中盛放的药品是
浓硫酸
浓硫酸
,B中盛放的药品是
氯化钙固体
氯化钙固体
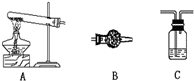
方案II:只测定分解生成的CO
2的质量,连接方案是A→C→B→C,则B中的药品是
碱石灰
碱石灰
,最后连接的C中的药品是
氢氧化钠溶液
氢氧化钠溶液
请你设计出更简单的实验方法
加热碱式碳酸镁称量反应前后固体质量
加热碱式碳酸镁称量反应前后固体质量
.
若取样品7.88克,方案I测得生成水0.36g,方案II测得生成CO
2 3.52g,请你选择实验数据,通过计算得出碱式碳酸镁的化学式.

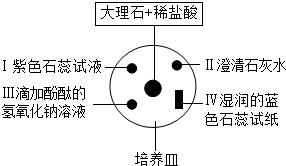 将一只大烧杯倒扣在培养皿上,培养皿上所放物质如图所示.下列对有关实验现象的描述,肯定不正确的是
将一只大烧杯倒扣在培养皿上,培养皿上所放物质如图所示.下列对有关实验现象的描述,肯定不正确的是


 所示.
所示.