
题目列表(包括答案和解析)
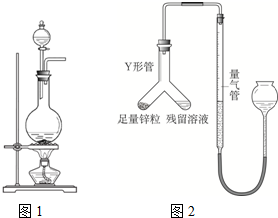 实验室常用MnO2与浓盐酸反应制备Cl2,其反应方程式为:
实验室常用MnO2与浓盐酸反应制备Cl2,其反应方程式为:
| ||
用下图的装置测量空气中氧气的含量.按要求填空:
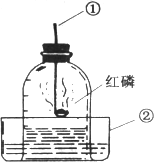
(1)写出标号①②仪器的名称:
①________;②________.
(2)在空气中点燃①中红磷,并迅速插入玻璃罩内,塞紧橡皮塞,此时看到的主要现象是:________.该变化的文字表达式为________.
(3)当红磷燃烧完毕,钟罩冷却到室温后,看到钟罩内水面的变化是________,出现该现象的的原因是:红磷燃烧消耗了空气中气态的________而生成了固态的________,从而使罩内气体的体积________(“增大”“减少”“不变”),钟罩内气体压强________(“大于”“小于”“等于”)钟罩外的大气压.
(4)上述实验除了可以得出氧气约占空气体积________的结论外,还可以得出有关氮气的哪些结论________、________、________.
(5)若实验中测得氧气的体积分数低于21%,造成此误差的可能原因有哪些?(至少三条)
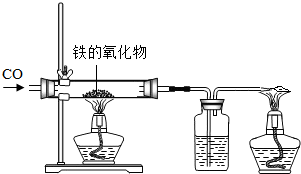 (1)小红用下图装置进行CO还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入CO并加热,使铁的氧化物与足量的CO充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为
(1)小红用下图装置进行CO还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入CO并加热,使铁的氧化物与足量的CO充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为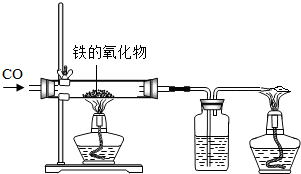 (1)小红用下图装置进行CO还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入CO并加热,使铁的氧化物与足量的CO充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为______;实验完毕称得洗气瓶的质量增加了______g.
(1)小红用下图装置进行CO还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入CO并加热,使铁的氧化物与足量的CO充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为______;实验完毕称得洗气瓶的质量增加了______g.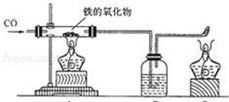
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com