
题目列表(包括答案和解析)
 25、在实验室里同学们用过氧化氢溶液与二氧化锰混合制取氧气(装置如下图).某小组甲、乙、丙三名同学用该装置进行实验过程中,橡皮塞突然被弹飞,并有少量的液体溅到实验台和衣服上.就此异常现象这三名同学进行了如下探究:
25、在实验室里同学们用过氧化氢溶液与二氧化锰混合制取氧气(装置如下图).某小组甲、乙、丙三名同学用该装置进行实验过程中,橡皮塞突然被弹飞,并有少量的液体溅到实验台和衣服上.就此异常现象这三名同学进行了如下探究:| 实验步骤 | 实验现象 | 结论 |
| |
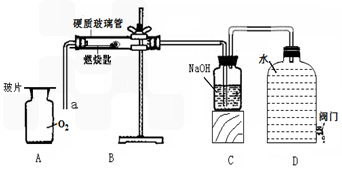
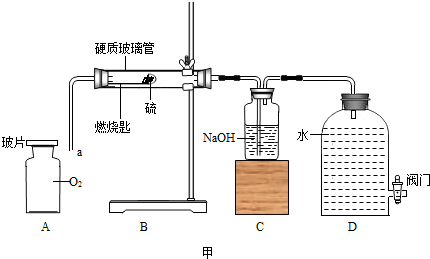

某校化学兴趣小组就空气中氧气的含量进行实验探究:
【集体讨论】:
(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其它成分反应,而且生成物为固体。他们应该选择(填编号) 为了充分消耗容器中的氧气,药品的用量应保证 。
A.蜡烛 B.红磷 C.硫粉
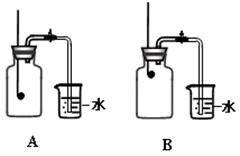
(2)小组同学共同设计了如下图的两套装置, 你认为合理的是(填编号) 。
为了确保实验的成功,在装药品之前应该 。
【分组实验】 在讨论的基础上,他们分组进行了实验。
【数据分析】 实验结束后,整理数据如下:(注:集气瓶容积为100mL)
| 组 别 | 1 | 2 | 3 | 4 | 5 | 6 |
| 进入集气瓶中水的体积(mL) | 20 | 21 | 19 | 20 | 22 | 18 |
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的 。
通过实验还可以推断集气瓶中剩余气体的物理性质是
化学性质是 。
【实验拓展】
(4)小组的同学做完实验后又尝试用木炭重新做了以上实验,发现水几乎没有进入集气瓶。经讨论,小组的同学反思上述实验的探究过程后认为:用燃烧法测定空气中氧气含量的实验时,在药品的选择或生成物的要求上应考虑的是(答一条)________________ 。
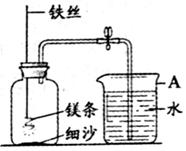
(5)某校研究性学习小组用右下图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%。
①右图A仪器的名称是 ,燃烧、冷却后打开止水夹,水能进入集气瓶的原因是 。
②如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的 %。现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有氮气。
【发现问题】氮气是怎样减少的呢?
【假设一】氮气与镁条反应而减少。
【假设二】 。
【查阅资料】镁条在氮气中能燃烧,产物为氮化镁固体。
该反应的文字表达式______ 。
镁条还可以在二氧化碳气体中燃烧生成碳和氧化镁,该反应文字表达式为________
。
(8分)工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠。某科学学习小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究。
【原理思路】利用Na2CO3与稀H2SO4反应产生CO2,通过CO2 质量的测定,确定样品中碳酸钠的质量,从而计算样品纯度。
【实验方案】小科同学根据以上思路,设计了如图甲的实验方案(固定装置省略)。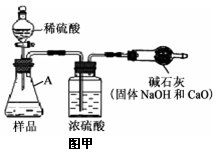
(1)A中发生反应的化学方程式为___________________。
(2)浓硫酸的作用为______。
【交流讨论】小明认为图甲实验方案的设计有缺陷,若按该方案进行测定会导致难以避免的误差。你认为下列哪些因素会导致难以避免的误差 ___________________(填序号)。
①加入的稀硫酸量不足 ②装置内空气中的CO2没有排出
③反应产生的CO2未被完全吸收 ④干燥管与空气直接相通
【方案改进】为减少误差,使CO2质量的测定更准确,该小组同学根据以上讨论,对图甲方案进行改进,设计了如图乙的实验方案(固定装置省略)。
图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的控制方法是___________________。
【数据分析】若撤去图乙中的C装置,则测得工业烧碱的纯度将___________________(填“偏高”、“偏低”或“无影响”)。
【拓展提高】已知Na2CO3溶液滴加稀硫酸并不断振荡,先生成NaHCO3,当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2。现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液。请分析推断反应后所得X溶液的溶质,其所有的可能组成为___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com