下面几位同学是测量空气中氧气体积含量的四个实验,请你参与他们的实验探究:
[实验一]小强采用A图所示的装置进行实验:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推拉两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化.
(1)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是
使空气中的氧气充分反应
使空气中的氧气充分反应
.
(2)该反应的化学反应表达式
,铜丝表面的变化是
红色变黑色
红色变黑色
.
(3)小强测得实验结果如下:
| 反应前注射器内气体总体积 |
反应后注射器内气体总体积 |
| 25mL |
22mL |
由此数据可以推算出他测定的空气中氧气的体积分数
<
<
2l%(填“>”、“=”、“<”).造成该实验出现误差的原因可能是
③
③
.(填序号,)
①没有交替缓缓推动两个注射器活塞;
②读数时没有冷却至室温;
③加入铜丝量太少;
[实验二]:小红采用B图所示的装置进行实验:实验过程如下:
第一步:将集气瓶容积划分为五等份,并做好标记.
第二步:用放大镜点燃燃烧匙内的红磷.
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5.
请回答下列问题:
(1)集气瓶中剩余的气体主要是
氮气
氮气
,根据实验推断它的性质有
难溶于水,既不能燃烧,也不能支持燃烧
难溶于水,既不能燃烧,也不能支持燃烧
.
(2)实验完毕,若进入集气瓶中水的体积小于总容积的
,其原因可能是
装置漏气、红磷的量不足
装置漏气、红磷的量不足
,若进入集气瓶中水的体积大于总容积的
,其原因可能是
装置内的部分空气逸散出来,就会导致进入集气瓶中水体积大于五分之一
装置内的部分空气逸散出来,就会导致进入集气瓶中水体积大于五分之一
.
(3)红磷燃烧的现象是
发出黄光,放出热量,冒出大量的白烟
发出黄光,放出热量,冒出大量的白烟
,化学反应表达式为
.
[实验三]小华同学打算采用C图所示的装置进行实验:设计如下方案:选用实际容积为25mL的试管作为反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管,通过导管与注射器(注射器的容积为40ml,且润滑性很好)相连,注射器的前沿停在20ml刻度处.(假设此实验能够按照小华的设想正常进行,白磷所占体积与导管内的气体体积忽略不计,且两个容器间的导管足够粗,保持空气正常流动.)请回答下列问题:
(1)实验前,打开弹簧夹,将注射器活塞前沿从20mL刻度处推至15mL刻度处,然后松开手,若活塞仍能返回至20mL刻度处,则说明
气密性良好
气密性良好
;
(2)若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,试管冷却后,再松开弹簧夹.可观察到的现象为:
注射器活塞在11mL刻度处
注射器活塞在11mL刻度处
;
(3)若不使用弹簧夹,用酒精灯加热白磷,燃烧结束,试管冷却.在实验的过程中观察到的现象为
有大量的白烟冒出
有大量的白烟冒出
,
注射器活塞先向右移动
注射器活塞先向右移动
,
试管冷却后,注射器活塞最后向左移动
试管冷却后,注射器活塞最后向左移动
.
(4)若按小华的设想进行实验,实际可能遇到诸多问题而发生危险,造成实验失败.例如:
试管受热不均匀而炸裂等
试管受热不均匀而炸裂等
.
[实验四]小明用图D装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%.
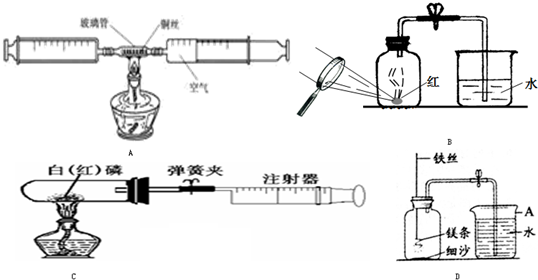
(1)如图A仪器的名称是
烧杯
烧杯
,
镁带燃烧的反应表达式为
、冷却后打开止水夹,水能进入集气瓶的原因是
镁与氧气反应,集气瓶内压强减少,内外产生压强差
镁与氧气反应,集气瓶内压强减少,内外产生压强差
.
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的
21
21
%.现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有
氮气
氮气
.


 ,其原因可能是________,若进入集气瓶中水的体积大于总容积的
,其原因可能是________,若进入集气瓶中水的体积大于总容积的 ,其原因可能是________.
,其原因可能是________.
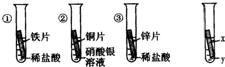
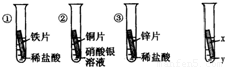
 某校化学兴趣小组对金属活动性顺序等知识进行了研究.
某校化学兴趣小组对金属活动性顺序等知识进行了研究.
