
题目列表(包括答案和解析)
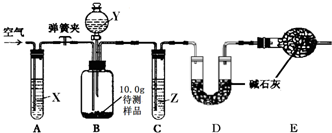
| 实验步骤 | 实验现象 | 实验结论 |
| a.取少量该溶液于一支试管中,加入 足量的氯化钙溶液 足量的氯化钙溶液 |
有白色沉淀生成 有白色沉淀生成 |
该氢氧化钠溶液已变质 |
| b.将步骤a所得的液体静置,取上层清液于另一支试管中,滴加 无色酚酞试液 无色酚酞试液 |
酚酞试液变红 酚酞试液变红 |
该氢氧化钠溶液已部分变质 |
 探究小组同学发现家中烧开水的铝壶和盛放开水的暖瓶,长时间使用会有白色固体附着,很难洗掉.
探究小组同学发现家中烧开水的铝壶和盛放开水的暖瓶,长时间使用会有白色固体附着,很难洗掉.| 实验步骤 | 实验现象与结论 |
| 在上述实验的试管中,加入 稀盐酸 稀盐酸 后,再将产生的气体通入澄清石灰水中 |
若有气泡产生且澄清石灰水变浑浊,则难溶物是 CaCO3 CaCO3 (或猜想1成立) |
| ||
| 该同学的观点 | 请说出你的观点并阐述理由 |
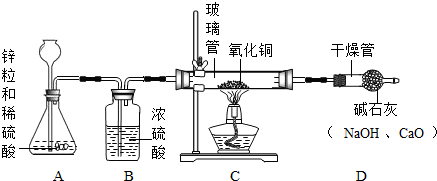
| ①该实验装置中C装置可以不要 | 不同意此观点,因为氧化钠溶液能吸收二氧化碳 不同意此观点,因为氧化钠溶液能吸收二氧化碳 |
| ②“结论2”不正确 | 同意此观点,根据质量守恒定律,反应前后原子的种类和数目不变,反应前有氢原子,反应后又无氢气生成,所以应有水生成. 同意此观点,根据质量守恒定律,反应前后原子的种类和数目不变,反应前有氢原子,反应后又无氢气生成,所以应有水生成. |
| 实验步骤 | 实验现象 | 实验结论 |
| a.取少量该溶液于一支试管中,加入 过量的氯化钙溶液,并不断振荡 过量的氯化钙溶液,并不断振荡 |
产生白色沉淀 产生白色沉淀 |
该氢氧化钠溶液已变质 |
| b.将步骤a所得的液体静置,取上层清液于另一支试管中,滴加 酚酞试液 酚酞试液 |
溶液变成红色 溶液变成红色 |
该氢氧化钠溶液已部分变质 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com