
题目列表(包括答案和解析)
(1)试写出纤维素与硝酸反应制取纤维素硝酸酯的化学方程式
(2)磷酸三丁醇酯是一种常用的萃取剂,试写出制备它的化学方程式
(3)核糖是一种五碳糖,它的衍生物腺苷也可与磷酸成酯如三磷酸腺苷,后者的分子简式为 。
(4)三磷酸腺苷释放能量的表示式是 。
(1)试写出纤维素与硝酸反应制取纤维素硝酸酯的化学方程式
。
(2)磷酸三丁醇酯是一种常用的萃取剂,试写出制备它的化学方程式
。
(3)核糖是一种五碳糖,它的衍生物腺苷也可与磷酸成酯如三磷酸腺苷,后者的分子简式
为 。
(4)三磷酸腺苷释放能量的表示式是 。
 填空 (1)现有A、B、C三种烃,其球棍模型如图:
填空 (1)现有A、B、C三种烃,其球棍模型如图: ;⑥
;⑥

(6分)填空题:
(1)(2分)下列实验操作不正确的是 (填字母代号)。
| A.在催化剂存在的条件下,苯和溴水发生反应可生成无色、比水重的液体溴苯。 |
| B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验。 |
| C.醇中含有少量水可加入生石灰再蒸馏制得无水乙醇。 |
| D.有朝一日宇航员乘坐“嫦娥”遨游月空时,在其轨道舱中无法完成“粗盐的提纯”实验 |
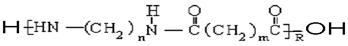 的单体为___________
的单体为___________ 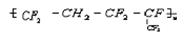 合成它的单体为________________________
合成它的单体为________________________
第I卷(共66分)
一、选择:(2×5=10分) 三、选择:(4×5=20分)
题号
1
2
3
4
5
题号
18
19
20
21
22
答案
A
C
D
D
D
答案
BC
B
AC
BD
C
二、选择:(3×12=36分)
题号
6
7
8
9
10
11
答案
D
C
C
B
C
D
题号
12
13
14
15
16
17
答案
D
D
A
B
C
C
第II卷(共84分)
四、(24分)
23.(8分):(1) H2SO4+V2O5→(VO2)2SO4+H2O,不是。(2分)
(2)2VO2+
+ H
2VO2+ (1分),V+5 (1分)。 VO2+在酸性条件下和Cl2氧化性的相对大小。(2分)
24.(8分) (1)BD(2分)
(2)C (1分) 该反应达到平衡时,平衡常数K=-----化学.files/image038.gif) ,增大容器体积时,
,增大容器体积时,
c(CH3OH)
c(CO)等比例减小,由于H2浓度不变,此时-----化学.files/image040.gif) 的值仍然等于K,所以平衡
的值仍然等于K,所以平衡
不移动。(2)
(3)越高(1分)
原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过高碳转化率又降低且有甲烷生成。(2分)
25.(8分)
(1)第三周期第VIIA族 5 (各1分,共2分) (2)H2O NH3 (2分)
(3)离子键 共价键(配位键不要求)(2分)(4)4NO + 3O2 + 2H2O → 4HNO3(2分)
五、(24分)
26(12分)(1) 防倒吸(1分) ①(2分)
(2)Cl2+SO2+2H2O→4H++2Cl?+SO42?(2分)
(3)②(1分)③(或④)(2分)溶液呈红色((或紫红色)(2分)⑥(1分)红色褪成无色(1分)
27.(12分)
(1)ABE(2分,对2个给1分,有错不给分)
(2)FeSO4?7H2O(1分),( NH4)2 SO4(1分);c(NH4+)>c(SO42-)> c(H+)>c(OH-) (2分)
(3)硫酸作用抑制Fe2+的水解,铁皮的作用防止Fe3+的氧化。(2分,各1分)
(4)在试管中取滤液少许,加入足量的NaOH溶液,加热,用湿润的红色石蕊试纸检验,若试纸变兰色,则证明滤液中含有NH4+。(2分)
(5)FeSO4+2NH4HCO3 →FeCO3↓+( NH4)2 SO4+ CO2↑+H2O(2分)
-----化学.files/image041.gif) 六、(20分)
六、(20分)
28.(8分)(1)①CH3-CH=CH-C≡C-CH=CH-C≡C-CH3 (2分) ② (其它合理也给分(2分)
-----化学.files/image042.gif) (2)
(2)
①2RHC=CHR’ RHC=CHR + R’HC=CHR’ (1分)
-----化学.files/image043.gif)
-----化学.files/image044.gif) ②RHC=CHR’
RHC=CHR + R’HC=CHR’ (1分)
②RHC=CHR’
RHC=CHR + R’HC=CHR’ (1分)
RHC=CHR’
③用同位素示踪法;利用含重氢的烯烃RCD=CHR’进行反应。若产物有RCD=CDR和R’CH=CHR’,证明反应按机理b进行;若产物有RCD=CHR和R’CD=CHR’, 证明反应按机理a进行。(1分)
29.(12分)(1) 2-丙醇 (1分)
-----化学.files/image046.jpg)
(2) (2分) 3 (2分)
-----化学.files/image048.jpg)
(3)(2分)CH3COCH3+2-----化学.files/image050.jpg) → H2O+
→ H2O+
取代反应(1分)
-----化学.files/image052.jpg) (4)6mol (2分)
(4)6mol (2分)
(5) 另一种是酚羟基与羧基之间缩聚:结构简式略。(各1分)
七、(16分)
30.(6分)(1)n(Fe)=
n(OH-)=3×n(Fe)-2×n(SO42-)=3×0.035-2×0.045=0.015mol (2分)
盐基度=n(OH-)/3n(Fe)×100%= 0.015 mol/(3×0.035 mol) ×100%=14.29% (2分)
(2)n(H2O)=(
31. (10分) (1)504 (1分)
(2)由题意可知,天然碱含
-----化学.files/image054.gif)
-----化学.files/image056.gif)
(2分)
(3)2.5 (2分) (4)0<W<4.98 V(CO2)=202.4W(mL)(2分)
4.98≤W≤12.45 V(CO2)=1680-134.9W(mL)(2分) W>12.45
V(CO2)=0 (1分)
注:30mL中所含HCl物质的量:
-----化学.files/image058.gif)
和30mL 完全反应的样品的质量:-----化学.files/image060.gif)
样品中和盐酸反应完全生成(没有放出时),样品的质量: -----化学.files/image062.gif)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com