
题目列表(包括答案和解析)
合成氨工业的部分工艺流程如下图所示:
请你回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=–905kJ·mol-1
2H2(g)+O2(g)=2H2O(g);△H=–483.6kJ·mol-1
则N2(g)+3H2(g)2NH3(g)的△H=_________________。
(2)改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是_________。
A.增大压强 B.降低温度 C.使用催化剂 D. 增大反应物的浓度
(3)在一定条件下,将2molN2与5molH2混合于一个10L的密闭容器中,反应情况如右图所示:
①求5min内的平均反应速率v(NH3)=_______________
②达到平衡时NH3的体积分数为___________%
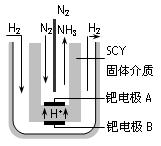
(4)近年来科学家提出了电解合成氨的方法:采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了高转化率的电解法合成氨(装置如图)
请回答:钯电极A是电解池的_______极(填“阳”或“阴”),该极上的电极反应式是_________________________
合成氨工业的部分工艺流程如下图所示: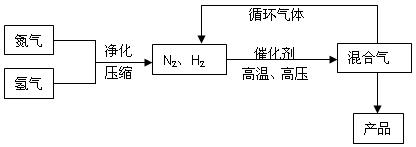
请你回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=–905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ;△H=–483.6kJ·mol-1
则N2(g)+3H2(g) 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。
(2)改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是_________。
| A.增大压强 | B.降低温度 | C.使用催化剂 | D.增大反应物的浓度 |
合成氨工业的部分工艺流程如下图所示:
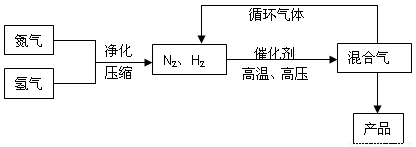
请你回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=–905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ;△H=–483.6kJ·mol-1
则N2(g)+3H2(g) 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。
(2)改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是_________。
A.增大压强 B.降低温度 C.使用催化剂 D. 增大反应物的浓度
(3)在一定条件下,将2molN2与5molH2混合于一个10L的密闭容器中,反应情况如右图所示:
①求5min内的平均反应速率v(NH3)=_______________
②达到平衡时NH3的体积分数为___________%
(4)近年来科学家提出了电解合成氨的方法:采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了高转化率的电解法合成氨(装置如图)
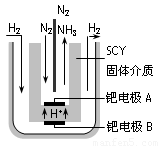
请回答:钯电极A是电解池的_______极(填“阳”或“阴”),该极上的电极反应式是_________________________
(14分)合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ?H=—92.4kJ?mol?1
2NH3(g) ?H=—92.4kJ?mol?1
一种工业合成氨的简易流程图如下:
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: 。
(2)步骤II中制氯气原理如下: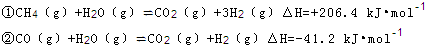
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。
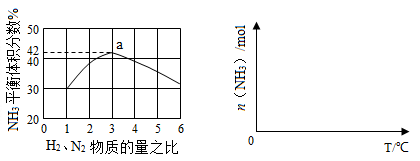
(3)下左图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数: 。
(4)依据温度对合成氨反应的影响,在下右图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。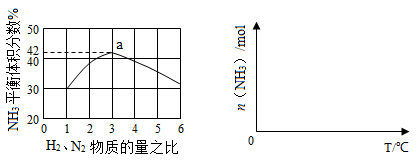
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,简述本流程中提高合成氨原料总转化率的方法: 。
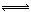 2NH3(g) ?H=—92.4kJ?mol?1
2NH3(g) ?H=—92.4kJ?mol?1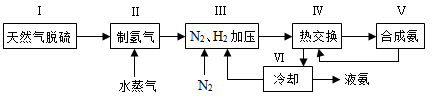
1―5 CBABD 6―9CBBB
10.答案:饱和溶液的物质的量浓度为:
析出晶体(不含结晶水)的质量为
11.答案
(1)该反应是放热反应
2Na2O2 + 2H2O = 4NaOH + O2↑
(2)打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成。
将导管Q浸入水中,反应过程中导管口有气泡冒出。
(3)溶液先变红后褪色。
(4)7.5%
(5)
实验操作
实验现象
结论
向盛有约2 ml 5%的H2O2溶液的试管中滴加入少量的
2 mol/L H2SO4,并把带火星的木条伸入试管。
无明显现象
起催化作用的不是SO42-
向盛有约2 ml 5%的H2O2溶液的试管中滴加入少量CuSO4溶液4,并把带火星的木条伸入试管。
试管中有大量气泡产生,带火星的木条复燃。
起催化作用的是Cu2+
12.答案
(1)药匙
(2)该混合物中肯定含有NH4HCO3,肯定不含有CuSO4 。
(3)
实验操作
预期现象和结论
向溶液B中滴加少量Ba(NO3)2溶液。
如果产生白色沉淀,说明原固体混合物中含有K2SO4;
如果没有白色沉淀产生,说明原固体混合物中不含K2SO4,(含有NaCl或NH4Cl。)
若固体混合物不含K2SO4(该句可以不写),取少量原固体混合物于试管底部, 将试管套入试管夹,用火柴点燃酒精灯,充分加热试管。
如果试管底部有固体残留,说明混合物中含有NaCl;
如果试管底部无固体残留,说明混合物中含有NH4Cl;
以下回答同样得分:
实验操作
预期现象和结论
取少量原固体混合物于试管底部,
将试管套入试管夹,用火柴点燃酒精灯,充分加热试管。
如果试管底部有固体残留,说明混合物中含有K2SO4或NaCl;
如果试管底部无固体残留,说明混合物中含有NH4Cl;
如果加热后试管底部有固体残留(该句可以不写),取残留固体加水溶解,滴加少量Ba(NO3)2溶液。
如果产生白色沉淀,说明原固体混合物中含有K2SO4;
如果没有白色沉淀产生,说明原固体混合物中含有NaCl。
13.答案
(1) ① 
图中要标明2、4、6 min时刻时的速率及要画出速率走向弧线
②镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大;4 min后由于溶液中H+浓度降低,所以导致反应速率减小。
(2)①原因Ⅱ:Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
原因Ⅴ:Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大)。
②反应速率加快; 反应速率减慢。
14.答案
(1) ①②④
(2)
(3) 
(4) 加成反应 水解(取代)反应
(5) 
15.答案:
(1)
(2)C 浓硫酸有吸水性,减小水的浓度有利于平衡向右移动。
(3)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com