
1.化学反应速率:通常用单位时间内反应物浓度的减小或生成物浓度的增加来表示,其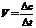 数学表达式可表示为单位一般为mol/(L?min)或mol.?L-1?min-1
数学表达式可表示为单位一般为mol/(L?min)或mol.?L-1?min-1
2.反应热的数值等于E(形成新键释放的总能量)与E(断键所吸收的总能量)之差,放热反应△H的符号为“―”,吸热反应△H的符号为“+”。
特别提醒:
(1)运用盖斯定律的技巧:参照目标热化学方程式设计合理的反应途径,对原热化学方程式进行恰当“变形”(反写、乘除某一个数),然后方程式之间进行“加减”,从而得出求算新热化学方程式反应热△H的关系式。
(2)具体方法:①热化学方程式乘以某一个数时,反应热也必须乘上该数;②热化学方程式“加减”时,同种物质之间可相“加减”,反应热也随之“加减”;③将一个热化学方程式颠倒时,DH的“+”“―”号也随之改变,但数值不变。
(4)注意1molH2、O2、、P4分别含有1molH-H、1mol O=O、6molP-P,1molH2O中含有2molO―H,1molNH3含有3molN-H ,1molCH4含有4molC-H。
第二章化学反应速率与化学平衡
1.由盖斯定律:化学反应不管是一步完成还是分步完成,其反应热总是相同的。也就是说,化学反应热只与反应的始态和终态有关,而与具体反应的途径无关。
(2)能源的开发;①太阳能:每年辐射到地球表面的能量为5×1019kJ,相当于目前全世界能量消耗的1.3万倍。②生物能:将生物转化为可燃性的液态或气态化合物,再利用燃烧放热。③风能:利用风力进行发电、提水、扬帆助航等技术,风能是一种可再生的干净能源。④地球能、海洋能。
4.注意表示燃烧热的热化学方程式和燃烧的热化学方程式;表示中和热的热化学方程式和表示中和反应的热化学方程式的不同。燃烧热以可燃物1mol为标准,且燃烧生成稳定的化合物;中和热以生成1mol水为标准。
要点二:能源
新能源的开发与利用,日益成为社会关注的焦点,因此,以新型能源开发与利用为背景材料,考查热化学方程式的书写及求算反应热,已成为高考命题的热点。
关于能源问题,应了解下面的几个问题:
(1)能源的分类:常规能源(可再生能源,如水等,非再生能源,如煤、石油、天然气等);新能源(可再生能源,如太阳能、风能、生物能;非再生能源,如核聚变燃料)
3.因燃烧热、中和热是确定的放热反应,具有明确的含义,故在表述时不用带负号,如CH4的燃烧热为890KJ/mol。
2.中和热是指酸、碱的稀溶液发生中和反应生成1 mol水所放出的热量。注意:弱酸、弱碱电离出H+、OH-需要吸收热量,故所测定中和热的数值偏小;浓硫酸与碱测定中和热时,因浓硫酸释稀要放热,故测定的中和热的数值偏大。
1.燃烧热指的是1 mol可燃物燃烧生成稳定的化合物时所放出的热量,注意:稳定的化合物,如H2→H2O(l)而不是H2O(g)、 C→CO2(g)而不是CO 、S→SO2(g)而不是SO3。
生成1mol水时放出的热量;强酸强碱的中和热约为57.3 kJ/mol
特别提醒:
可能是1mol,也可能是0.5mol
生成物的量
不限量
H2O是1mol
含义
1mol反应物完全燃烧时放出的热量;不同反应物,燃烧热不同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com