
4.双水解是指阴阳离子均水解,且水解程度较大,一般能进行到底,此类水解用“=”表示,生成物中的沉淀、气体要用“↓”或“↑”标出,如Al3+与AlO2-、HCO3-、HS-、S2-之间均发生双水解反应,如Al3++ 3HS-+3H2O=Al(OH)3↓+3H2S↑
六、盐类的水解
要点一:盐类水解规律
3.多元弱碱阳离子的水解方程式一步完成。例如FeCl3水解:FeCl3+3H2O  Fe(OH)3+3H+
Fe(OH)3+3H+
2.多元弱酸对应的盐水解方程式与多元弱酸的电离方程式一样也是分步进行,不能合并。
1.因单个离子水解程度较弱,故水解反应方程式用“ ”,生成的产物少,生成物一般不标“↓”或“↑”。
”,生成的产物少,生成物一般不标“↓”或“↑”。
3.多元弱碱的电离与多元弱酸的电离情况相似,但常用一步表示:Fe(OH)3 Fe3++3OH-
Fe3++3OH-
要点二:水解方程式的书写
如H2CO3电离: H2CO3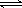 HCO3-+H+ ,HCO3-
HCO3-+H+ ,HCO3-
 CO32-+H+
CO32-+H+
2.多元弱酸分步电离,以第一步电离为主:
如CH3COOH H++CH3COO-
H++CH3COO-
1.由于弱电解质在溶液中部分电离,故写电离方程式时用“ ”符号,
”符号,
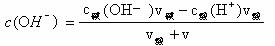 根据c(H+)= Kw/ c(OH-),求c(H+)
根据c(H+)= Kw/ c(OH-),求c(H+)
五、电离方程式和水解方程式的书写
要点一:电离方程式的书写
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com