
答案:⑴124.2;⑵C3H8+5O2=3CO2+4H2O;负;⑶4.2×10-7 mol?L-1;⑷> HCO3-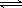 CO32-+H+
CO32-+H+
⑷常温下,0.1 mol?L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
⑶碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol?L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3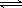 HCO3-+H+的平衡常数K1=
。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=
。(已知:10-5.60=2.5×10-6)
CH3CH=CH2(g)====CH4(g)+HC≡CH(g) △H2=32.4kJ?mol-1
则相同条件下,反应C3H8(g)====CH3CH=CH2 (g)+H2(g)的△H= kJ?mol-1。
⑵以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时,CO32-移向电池的 (填“正”或“负”)极。
已知:C3H8(g)====CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ?mol-1
29.(12分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
⑴丙烷脱氢可得丙烯。
⑴冶炼铜的反应为8CuFeS2+21O2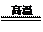 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
⑵上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4
d.用浓硫酸吸收
⑶过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。 、 (不必配平)
⑷利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
答案:⑴Cu、O;⑵b、c;⑶2Fe3++2I-=2Fe2++I2;S2O82-+2Fe2+=2SO42-+2Fe3+;(离子方程式不配平不扣分)⑷a:2Al3++4OH-=AlO2-+2H2O[或Al3++4OH-=Al(OH)4-];b:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
28.(14分)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
提示:BaSO4(s) 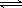 Ba2+(aq)+SO42-(aq)的平衡
Ba2+(aq)+SO42-(aq)的平衡
常数Ksp=c(Ba2+)?c(SO42-),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
【必做部分】
15.某温度时,BaSO4在水中的沉淀溶剂诶平衡曲线如图所示。下列说法正确的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com