
6.6
5.24
(2)
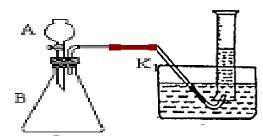 步骤2加2mL蒸馏水的目的是_________
步骤2加2mL蒸馏水的目的是_________
(3) 步骤1加热的目的是________________
Ⅱ、(10分)课外活动小组的三名同学甲、乙、丙用右图装置探究不同催化剂(CuO、MnO2、Fe2O3)对H2O2分解反应速率的影响。
查阅资料:催化剂密度见下表
催化剂
Fe2O3
CuO
MnO2
密度g/cm3

 根据上图回答下列问题
根据上图回答下列问题
(1) 步骤4的操作叫______________
28、(本题16分)
Ⅰ、(8分)将
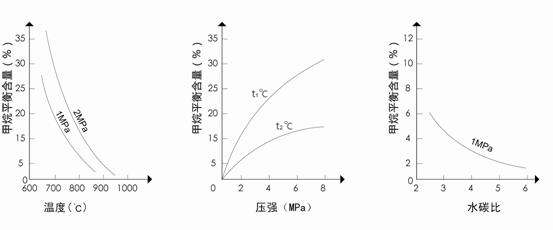
图1(水碳比为3)
图2(水碳比为3)
图3(
(1)判断反应的△H和△S,再椐此判断该反应自发的条件是_________
(2)该反应平衡常数K表达式为________________________。
(3)升高温度,平衡常数K__________(选填“增大”、“减小”或“不变”,下同),降低反应的水碳比,平衡常数K__________。
(4)图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);在图3中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。
(5)工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10-7%,其目的是____________________________。
(6)假设上述反应在恒容、恒温下进行并达到平衡时,新平衡时的标志是____________
(此题多选为0分)
①CO减少的化学反应速率和H2O(g)减少的化学反应速率相等
②CO、H2O(g)、CH4、H2的浓度都相等
③CO、H2O(g)、CH4、H2的浓度都不再发生变化
④正、逆反应速率都为零
已知温度、压强和水碳比[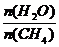 ]对甲烷蒸汽转化反应的影响如下图:
]对甲烷蒸汽转化反应的影响如下图:
27、(14分)甲烷蒸气转化反应为:CH4(g)+H2O(g) CO(g)+3H2(g),工业上可利用此反应生产合成氨原料气H2。
CO(g)+3H2(g),工业上可利用此反应生产合成氨原料气H2。
 (2)A、B、D可以形成两种18电子分子,两分子发生反应的化学方程式为________
(2)A、B、D可以形成两种18电子分子,两分子发生反应的化学方程式为________
(3)用A和B的单质可以制成原电池,电解液为浓KOH溶液,用多孔的铂电极浸入KOH溶液中,分别向两根多孔铂电极通入A和B两种气体,通入A的单质的电极为________极,电极反应式为_________________。
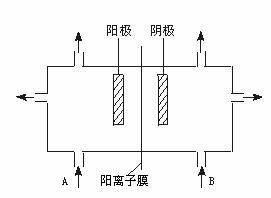
(4)右图为工业电解食盐水装置的示意图, B口加入的物质是________,电解食盐水的离子方程式为_________________。
26、(14分)A、B、C、D、E是5种短周期中的主族元素,它们的原子序数依次增大,其中A、C与B、D分别是同主族元素,又知B、D两元素的原子中质子数之和是A、C两元素原子中质子数和的2倍,这五种元素的单质中有三种为气体,2种为固体。
(1)A和B组成的化合物比A和D组成化合物的沸点高,原因是_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com