
18.(10分)硫酸亚铁铵(NH4)2SO4•FeSO4•6H2O是一种重要化学试剂,可以用除去锌镀层的铁片来制取硫酸亚铁铵,流程如下:
 |
(2) 图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是_________(选填“吸热”或“放热”)反应,写出反应的热化学方程式____________________________;选择适宜的催化剂, ______(填“能”或“不能”)改变该反应的反应热;
(3) 该反应平衡常数K的表达式为______________,温度升高,平衡常数K_________(填“增大”、“不变”或“减小”);
(4)恒容条件下,下列措施中能使 增大的有______。
a.升高温度; b.充入He气 c.再充入1molCO和2molH2 d.使用催化剂
CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。
17.(8分)工业上用CO生产燃料甲醇。一定条件下发生反应:
(3)写出反应⑦的化学方程式 当有0.3 mol电子转移时,生成G的物质的量为 。
(4)在反应②、③、⑥、⑨中,既属于化合反应又能属于非氧化还原反应的是________(填写序号)。
(5)反应④的离子方程式是:____________________________________________。
(6)将化合物D与KNO3、KOH混合,在高温条件下可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:

请填写下列空白:
(1)A的化学式为 ,I的原子结构示意图为 。
(2)在周期表中,组成单质G的元素在周期表中的位置是_________________。
16.(12分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是第三周期半径最小的金属元素组成的单质,K是一种红棕色气体。
纯正丁醚的沸点为
请回答下列问题:
(1)步骤(1)中加入沸石的目的: ,冷凝管的作用是 。
(2)油水分离器的体积为5ml,则预先在分水器加入V mL水,理论上V约为 。
(3)若实验中分出的水量超过理论数值,试分析其原因 。
(4)步骤(3)中用16 mL 50%硫酸分2次洗涤的目的是: 。
(1)如右图所示,在干燥的50 mL园底烧瓶中,放入20.5 mL (
(2)随反应的进行,分水器中液面增高,这是由于反应生成的水,以及未反应的正丁醇,经冷凝管冷凝后聚集于分水器内,由于比重的不同,水在下层,而上层较水轻的有机相积至分水器支管时即可返回反应瓶中,继续加热,分水器被水充满时,表示反应已基本完成,约需1h。
(3)反应物冷却后,把混合物连同分水器里的水一起倒入盛有25 mL水的分液漏斗中,充分振摇,静止后,分出粗产物正丁醚,用16 mL 50%硫酸分2次洗涤,再用10 mL水洗涤。然后用无水氯化钙干燥。将干燥后的产物倾入蒸馏烧瓶中,加热蒸馏,收集139~
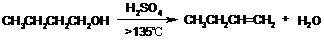 |
[仪器和药品]
仪器:50 mL园底烧瓶、回流冷凝管、油水分离器、分液漏斗。
药品:正丁醇、浓硫酸、50%硫酸、无水氯化钙
[实验步骤]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com