
N2(气)+ 3 H2(气) 2
NH3(气),平衡时混合气共7
mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
2
NH3(气),平衡时混合气共7
mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
(1)若a=0,b=0,则c= .
28.向体积不变的密闭容器中充入2 mol N2和6 mol H2,一定条件下发生反应:
(2)将一定量的SO2(g)和O2(g)放入
(3)体积不变的条件下,下列措施中有利于提高SO2的转化率的是_____________(填字母)。
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(4)工业制硫酸的尾气中含有少量SO2 ,可用氨水吸收。
反应的化学方程式为________________________________。
27.工业制硫酸的核心反应是
:2SO2(g)+ O2(g) 2SO3(g)
ΔH<0,回答下列问题:
2SO3(g)
ΔH<0,回答下列问题:
(1)此反应的平衡常数表达式为K=_______________,随着温度的升高,上述平衡常数_______(填“增大”、“减小”或“不变”)。
 ① X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
① X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。请回答:
⑴Z2Y的化学式是 ,
⑵Z2Y2与X2Y反应的化学方程式是 。
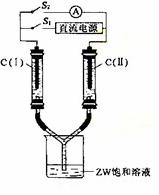
⑶如图所示装置,两玻璃管中盛满滴有酚酞的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1 后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(Ⅰ)的电极名称是 (填写正极或负极);
C(Ⅱ)的电极反应式是 。
⑷铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是:
26.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
 溶液。肼―空气燃料电池放电时:
溶液。肼―空气燃料电池放电时:
正极的电极反应式是
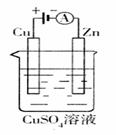
(3)右图是一个电化学过程示意图。
假设使用肼―空气燃料电池作为本过程中的电源,铜
片的质量变化为
耗标准状况下的空气 L(假设空气中氧气体
积含量为20%)
已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ
(
(2)肼―空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH
25.(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。
A.φ1>φ2
B.φ1<φ 学科网
学科网
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com