
40.(7分)A、B、C是初中化学常见的物质。它们可能是O2、H2O、H2O2、Fe、CaO、Fe2O3、HCl、NaOH、Ca(OH)2、Na2CO3中的一种。
(1)若A、B是由相同元素组成的化合物,且B分解能产生A和C。请写出该化学反应方程式 。
(2)若A、B中含有相同的金属元素,并均可与C的溶液反应,生成金属元素化合价不同的两种盐溶液。则C的化学式是 ; 请写出能产生黄色溶液的化学反应方程式 。
请写出能产生黄色溶液的化学反应方程式 。
(3)若A、B、C中含有一酸、一碱、一盐,将它们依次加入同一个烧杯中。
①若均无明显现象,则A、B、C可能是 。
②若能产生白色沉淀,请写出酸、碱中和的化学反应方程式 。
③若只产生气泡,实验后溶液中溶质的可能组成是 。
39.(8分)金属在生产生活中应用广泛。
(1)下列金属制品中,利用金属导热性的是 。(填序号)

A.铜火锅 B.不锈钢炒锅 C.铁丝网 D.金牌
(2)新买来的轴承表面都涂有一层机油,其目的是使铁与 隔绝,防止生锈。
(3)工人师傅切割铁板时,常用硫酸铜溶液在铁板上画线即可留下红色的印迹,此过程中发生的化学方程式为 。
 (4)实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染。于是几位同学设计实验处理废液,回收工业重要原料硫酸锌和有关金属。实验过程如下:
(4)实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染。于是几位同学设计实验处理废液,回收工业重要原料硫酸锌和有关金属。实验过程如下:
 请回答:
请回答:
Ⅰ.操作①的名称是 。
Ⅱ.步骤①中加入过量M的化学式 。请写出工业上 用赤铁矿(主要成分为Fe2O3)炼铁的化学方程式 。
用赤铁矿(主要成分为Fe2O3)炼铁的化学方程式 。
Ⅲ.若加入一定量M(不考虑上述实验过程中后续实验现象和结论),则滤液A中一定含有的溶质的化学式是 。
38.(6分)水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)如右图为电解水的实验装置图,此实验说明水是由 组成。
 (2)下表是NaOH和Ca(OH)2的溶解度数据,请回答下列问题。
(2)下表是NaOH和Ca(OH)2的溶解度数据,请回答下列问题。
|
温度(℃) |
0 |
20 |
40 |
60 |
80 |
100 |
|
|
溶解度 (g) |
NaOH |
31 |
91 |
111 |
129 |
313 |
336 |
|
Ca(OH)2 |
0.19 |
0.17 |
0.14 |
0.12 |
0.09 |
0.08 |
①石灰水中的溶质是 。
②把80℃时NaOH和Ca(OH)2的饱和溶液降温至20℃,析出的晶体是 ;现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后,恢复到原温得到的溶液(乙溶液),此时溶液的溶质质量分数甲 乙(填>、<、=),其原因是 。
③在20℃时,向盛有100g水的烧杯中加入111gNaOH,欲使其完全溶解变成不饱和溶液。下列说法中正确的是 。
A.溶液的质量可能不变 B.溶液中溶质的质量分数一定减小
C.溶液中溶质的质量一定增大 D.可以升温到40℃以上
二、填空题
36.(6分)化学与人类的生活和社会发展密切相关。
(1)下列菜品中,含蛋白质最丰富的是 。(填序号)



A.蜜汁红芋 B.粉丝娃娃菜 C.鱼咬羊 D.香菇板栗
(2)目前,人类以化石燃料 为主要能源,常见的化石燃料包括煤、石油和 。
为主要能源,常见的化石燃料包括煤、石油和 。
自热米饭是利用发热包中的生石灰与水反应放出热量来进行加热,生石灰与水反应的化学方程式为 。
(3)次氯酸钠(NaClO)是常用的饮用水消毒剂,它的消毒原理是溶于水后与水反应生成次氯酸(HClO),利用次氯酸的强氧化性消毒杀菌。如果保存不当,NaClO还会与空气 中的二氧化碳和水反应生成碳酸(Na2CO3)和次氯酸,致使消毒剂变质而失效。
中的二氧化碳和水反应生成碳酸(Na2CO3)和次氯酸,致使消毒剂变质而失效。
①用NaClO对饮用水进行消毒的方法属于 (选填“物理”或“化学”)方法。
②NaClO中Cl元素的化合价是 。
③写出NaClO与二氧化碳和水反应的化学方程式: 。
|
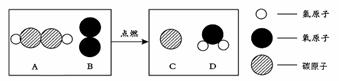
(1)上述物质中由分子构成的是 (填序号);一个A分子是由 个原子构成。
(2)上述反应中,A与D的质量比为 。
35. 向一定量的硫酸溶液中,分别加入足量的水、金属锌、氢氧化钠溶液、碳酸钠溶液,下列图示正确的是
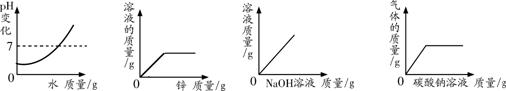
A
B C  D
D
34. 一个密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得数据见下表。下列说法中正确的是
|
物质 |
甲 |
乙 |
丙 |
丁 |
|
反应前质量 |
8g |
35g |
5g |
8g |
|
反应后质量 |
2g |
x |
5g |
42g |
A.该反应是分解反应
B.在该反应的化学方程式中,丙、丁的化学计量数之比为1∶l
C.x=7g
D. 在该反应中,丙物质一定做催化剂
在该反应中,丙物质一定做催化剂
33.硅(Si)是太阳能电池和电脑芯片不可缺少的材料。利用石英沙(主要成分为二氧化硅)生产高纯硅 的流程示意图如下,整个制备过程必须达到无水、无氧气。下列说法中,不正确的是
的流程示意图如下,整个制备过程必须达到无水、无氧气。下列说法中,不正确的是
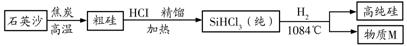
|
A.M的化学式是HCl |
|
B.制备过程无氧气,可能是为防止发生爆炸 |
|
C.制备过程无水,可能是防止制备过程中某些物质与水反应 |
D.为了达到绿色化学和节约资源的目的,可重复利用的 物质是C和HCl 物质是C和HCl |
32. 丁酸乙酯(C6H12O2)常用作食品、饮料的调香剂。下列有关叙述中正确的是
A.丁酸乙酯是由20个原子构成的
B.丁酸乙酯的相对分子质量为116g
C.丁酸乙酯中碳元素的质量分数为62.1%
D.一个丁酸乙酯分子中,碳、氢、氧原子的个数比为18∶3∶8
31. 除去下列物质中混有的少量杂质,所选用的试剂及操作方法不正确的是
|
序号 |
物质 |
杂质(少量) |
试剂和操作方法 |
|
A |
O2 |
H2O蒸汽 |
通过浓硫酸 |
|
B |
NaCl溶液 |
Na2CO3 |
滴加适量的盐酸溶液至不再产生气泡 |
|
C |
NaCl固体 |
泥沙 |
加水溶解、过滤、蒸发结晶 |
|
D |
CO2 |
HCl |
适量的NaOH溶液 |
30.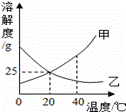 如图所示为甲、乙两种固体的溶解度曲线,下列说法错误的是
如图所示为甲、乙两种固体的溶解度曲线,下列说法错误的是
A.甲、乙两种物质的溶解度随温度的变化趋势不同
B.20℃时,甲、乙两种物质的溶解度相等
C.20℃时,把30g甲物质加入100g水中,充分溶解后所得
溶液为饱和溶液
D.将40℃时甲、乙饱和溶液降温到20℃时,甲的溶质质量分数等于乙
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com