
2.生成更难电离的物质优先
如①向CH3COONa和NaOH的混合液中加入少量盐酸,OH-先反应生成H2O,结合H+的能力为OH->CH3COO-。
②向含H+、Mg2+、Fe3+的溶液中,加入足量的NaOH溶液,开始没有沉淀。


某溶液中可能含有H+、NH、Mg2+、Al3+、Fe3+、CO、SO、NO中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH)=0.2 mol
C.溶液中一定不含CO,可能含有SO和NO
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
[解析] 由图象可知,反应先后顺序为H+→Mg2+、Al3+→NH→Al(OH)3。由①知溶液中一定含有H+,一定没有CO、NO,由②知溶液中一定含有Mg2+、Al3+,由图象可知溶液中还一定含有NH,且n(NH)=0.7 mol-0.5 mol=0.2 mol,n(H+)=0.1 mol,n(Al3+)=0.8 mol-0.7 mol=0.1 mol,沉淀Al3+、Mg2+共消耗0.4 mol OH-,其中沉淀Al3+消耗0.3 mol OH-,沉淀Mg2+消耗0.1 mol OH-,根据Mg2+~2OH-,可得n(Mg2+)=0.05 mol,故只有选项B正确。
[答案] B
类型2 氧化还原反应型
若某一溶液中同时含有多种还原性(氧化性)物质,则加入一种氧化剂(还原剂)时,优先氧化(还原)还原性(氧化性)强的物质。
1.生成更难溶解的物质优先
如:①向Mg(HCO3)2的溶液中加入足量NaOH溶液生成Mg(OH)2不是MgCO3,结合Mg2+的能力为OH->CO。
②向Na2S和NaOH的混合液中加入少量CuSO4溶液生成CuS不是Cu(OH)2,CuS比Cu(OH)2更难溶。
6.如图表示各物质之间的转化关系。已知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。

写出下列物质的化学式:B________、G______、Y______。
[解析] 由题干信息和框图转化关系得,D、E、Z分别为Al、Fe、Cl2,X、Y分别为HCl、NaOH,则A、B、C、F、G、M分别为FeCl3、FeCl2、FeO、Al2O3、NaAlO2和Al(OH)3(或AlCl3)。
[答案] FeCl2 NaAlO2 NaOH
5.已知A~I均为中学化学中的常见物质,它们之间的转化关系如图所示,其中A、D为金属单质,反应过程中需要或生成的水及其他部分产物已略去。
请回答以下问题:
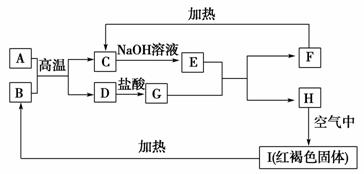
(1)B和F分别是________(填化学式)。
(2)写出下列反应的化学方程式。
①A与B在高温下反应:_________________________________________________。
②H在空气中转变为I:__________________________________________________。
(3)E溶液中所有离子浓度由大到小的顺序是________。
(4)用离子反应方程式表示G溶液呈酸性的原因_____________________________;
该反应的平衡常数为________(已知常温下,H的溶度积常数Ksp=8.0×10-16)。
[解析] (1)根据框中转化信息及题干信息,可以确定I为氢氧化铁。A、D为金属单质,根据A和B的反应条件就可以联想到铝热反应,推测A、D为铝和铁,即A为铝,B为氧化铁,C为氧化铝,D为铁,E为偏铝酸钠,G为氯化亚铁,F为氢氧化铝,H为氢氧化亚铁,I为氢氧化铁。(3)偏铝酸钠水解使溶液呈碱性,所以溶液中离子浓度大小顺序为c(Na+)>c(AlO)>c(OH-)>c(H+)。(4)FeCl2溶液中,Fe2+发生水解:Fe2++2H2O Fe(OH)2+2H+,平衡常数K=c2(H+)/c(Fe2+)===1.25×10-13。
Fe(OH)2+2H+,平衡常数K=c2(H+)/c(Fe2+)===1.25×10-13。
[答案] (1)Fe2O3、Al(OH)3
(2)①Fe2O3+2Al2Fe+Al2O3
②4Fe(OH)2+2H2O+O2===4Fe(OH)3
(3)c(Na+)>c(AlO)>c(OH-)>c(H+)
(4)Fe2++2H2O Fe(OH)2+2H+ 1.25×10-13
Fe(OH)2+2H+ 1.25×10-13
4.(2012·四川高考)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。

请回答下列问题:
(1)B中所含元素位于周期表中第________周期,______族。
(2)A在B中燃烧的现象是________。
(3)D+E―→B的反应中,被氧化与被还原的物质的物质的量之比是________。
(4)G+J―→M的离子方程式是______________________________________。
(5)Y受热分解的化学方程式是_______________________________________。
[解析] 解题的关键是利用物质的颜色进行突破。I为红棕色气体氧化物,一定是NO2;M为红褐色沉淀,一定是Fe(OH)3;F是地壳中含量最多的金属元素的单质,一定是Al;X电解生成三种物质,其中A、B是气态单质且能反应生成D,猜测是电解NaCl溶液,生成的H2和Cl2反应生成HCl,盐酸能与黑色固体E(氧化物)反应生成气体B,则E应是MnO2,B是Cl2,则A是H2。NO2和H2O反应生成HNO3(N),HNO3和Fe(OH)3反应生成Fe(NO3)3(Y),Fe(NO3)3可分解生成Fe2O3(H),Fe2O3与HCl反应生成FeCl3(J),NaOH(C)与Al反应生成NaAlO2(G),Fe3+和AlO可以发生双水解反应生成Fe(OH)3(M)。
[答案] (1)三 ⅦA (2)产生苍白色火焰
(3)2∶1
(4)3AlO+Fe3++6H2O===3Al(OH)3↓+Fe(OH)3↓
(5)4Fe(NO3)32Fe2O3+12NO2↑+3O2↑
5.从常见的工业制法寻找
(1)应用电解法冶炼的金属是钠、镁、铝等。
(2)用电解饱和食盐水法制得的是氯气、氢气和NaOH。
(3)在高温下,用焦炭还原二氧化硅制取的是粗硅。
(4)用一种气体在另一种气体中燃烧,再将产物溶于水的方法制取的是盐酸。
 如图所示的框图中,A~I都是由短周期元素组成的常见物质。其中A是气体,它的水溶液呈碱性;氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒;单质E可作半导体材料。
如图所示的框图中,A~I都是由短周期元素组成的常见物质。其中A是气体,它的水溶液呈碱性;氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒;单质E可作半导体材料。

(1)化合物A的化学式是________,氧化物G的电子式是________。
(2)组成单质E的元素在元素周期表中的位置是____________;H+I反应的化学方程式为_______________________。
(3)标准状况下,将2.24 L氧化物F和1.68 L单质B同时通入1 L氧化物G中(反应前后溶液体积的变化忽略不计),发生反应的化学方程式为___________________________,所得溶液的pH=________。
此时再向溶液中通入2.24 L化合物A,完全反应后所得溶液的pH________(填“>7”“<7”或“=7”),用离子方程式表示其原因:___________________________。
(4)单质B和单质C在一定条件下可组成原电池(用KOH溶液作电解质),则该原电池负极的电极反应式为_________。
[解析] 本题突破口较多,根据题意可知A为NH3,氧化物D和F分别为CO和NO,单质E为Si,根据框图可推得其他物质。单质B、C、H分别是O2、H2和C;氧化物G、I分别是H2O和SiO2。
(3)n(NO)=0.1 mol,n(O2)=0.075 mol,n(NO)∶n(O2)=4∶3,故发生的反应为4NO+3O2+2H2O===4HNO3,生成的n(HNO3)=n(NO)=0.1 mol,c(H+)=0.1 mol·L-1,溶液的pH=1。通入0.1 mol氨气后与硝酸恰好完全反应生成NH4NO3,NH4NO3水解显酸性。
[答案]


无机框图推断题的解题思路


4.从特殊反应条件寻找
(1)高温条件
C+H2O(g)高温H2+CO
3Fe+4H2O(g)高温Fe3O4+4H2
CaCO3高温CaO+CO2↑
SiO2+CaCO3CaSiO3+CO2↑
SiO2+2CSi+2CO↑
SiO2+CaOCaSiO3
SiO2+Na2CO3Na2SiO3+CO2↑
2Al+Fe2O3Al2O3+2Fe
(2)高温、高压、催化剂
N2+3H2 2NH3
2NH3
(3)催化剂、加热
4NH3+5O2催化剂△4NO+6H2O
2SO2+O2 2SO3
2SO3
2KClO3MnO2△2KCl+3O2↑
(4)放电:N2+O22NO
(5)电解
2NaCl+2H2O2NaOH+H2↑+Cl2↑
2NaCl(熔融)2Na+Cl2↑
MgCl2(熔融)Mg+Cl2↑
2H2O2H2↑+O2↑
2Al2O3(熔融)4Al+3O2↑
3.从特征反应现象寻找
(1)焰色反应:Na+(黄色)、K+(透过蓝色钴玻璃显紫色)。
(2)能使品红溶液褪色的物质:加热恢复原色的是SO2,不恢复的是Cl2、NaClO、Ca(ClO)2、次氯酸盐、氯水、过氧化钠、过氧化氢、活性炭等。
(3)白色沉淀[Fe(OH)2]红褐色[Fe(OH)3](由白色→灰绿色→红褐色)。
(4)通CO2变浑浊:澄清石灰水(CO2过量变清)、Na2SiO3溶液、饱和Na2CO3溶液、浓苯酚钠溶液、NaAlO2溶液。
(5)气体燃烧火焰呈苍白色:H2在Cl2中燃烧。
(6)使湿润的淀粉碘化钾试纸变蓝:Cl2、Br2、FeCl3、碘水等。
(7)相遇形成白烟或固体的:NH3+HCl、NH3+HBr、NH3+HNO3、H2S+SO2、H2S+Cl2。
(8)既能跟酸反应又能跟碱反应且生成气体的物质一般是Al、NH4HCO3、(NH4)2CO3、NH4HSO3、(NH4)2SO3、(NH4)2S、NH4HS。
(9)与碱反应产生气体的物质是Al、Si、铵盐,产生的气体一般是H2、NH3。
(10)常温时与水反应产生气体的物质一般是Na、F2、Na2O2。
(11)既能与酸反应又能与碱反应的物质是Al、Al2O3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐。
(12)两种物质反应既产生沉淀又产生气体的一般是CaC2、Al2S3、Mg3N2与H2O,S2O与H+,CO、HCO、SO、HSO、S2-、HS-与Al3+,CO、HCO与Fe3+。
2.从典型性质寻找
(1)有色固体
|
白色 |
Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3、铵盐 |
|
淡黄色 |
Na2O2、AgBr |
|
黄色 |
S、FeS2、AgI、Au |
|
黑色 |
C、CuS、Cu2S、FeS、MnO2、FeO、Fe3O4、CuO |
|
紫黑色 |
I2、KMnO4 |
|
红色或红棕色 |
Cu(紫红色)、Cu2O(红)、Fe2O3(红棕色) |
|
红褐色 |
Fe(OH)3 |
(2)有色盐溶液
Cu2+(蓝)、MnO(紫红)、Fe2+(浅绿)、Fe3+(棕黄)、Fe(SCN)3(红色)。
(3)具有特殊性质的气体
①有颜色的气体:F2(淡黄绿色)、Cl2(黄绿色)、NO2(红棕色)、溴蒸气(红棕色)。其余均为无色气体。
②有刺激性气味的气体:HF、HCl、HBr、HI、NH3、SO2、NO2、F2、Cl2、溴蒸气。
③有臭鸡蛋气味的气体:H2S。
④易溶于水的气体:HF、HCl、HBr、HI、NH3、SO2和NO2。
⑤能溶于水的气体:CO2、Cl2、H2S和溴蒸气。
⑥易液化的气体:NH3、SO2、Cl2。
⑦有毒的气体:F2、HF、Cl2、H2S、SO2、CO、NO、NO2和溴蒸气。
⑧在空气中易形成白雾的气体:HF、HCl、HBr、HI等。
⑨可使紫色石蕊试纸变蓝且水溶液呈弱碱性的气体:NH3。
⑩有水时有漂白作用的气体:Cl2和SO2。
⑪能使澄清石灰水变浑浊的气体:CO2、SO2、HF。
⑫能使无水CuSO4变蓝的气体:水蒸气。
⑬在空气中点燃后火焰呈淡蓝色的气体:H2S、CH4、CO、H2。
⑭与水可发生反应的气体:Cl2、F2、NO2、溴蒸气、CO2、SO2、NH3。其中Cl2、F2、NO2、溴蒸气和水的反应属于氧化还原反应。
⑮在空气中易被氧化变色的气体:NO。
⑯能使湿润的KI淀粉试纸变蓝的气体:Cl2、NO2、溴蒸气。
⑰遇AgNO3溶液可产生沉淀的气体:H2S、Cl2、溴蒸气、HCl、HBr、HI、NH3。
二、无机推断题的备考方略
在解无机推断题时,首先应该认真审题,弄清题意和要求、已知和未知条件及其相互关系,找出明显的条件和隐含的条件。其次是通过结构特征、性质特征、反应特征和现象特征,确定某一物质或成分的存在,并以此作为突破口进行推断,最后验证结论是否符合题意。
在解题时,特征联想和猜测验证特别重要。如果有特征信息,要善于捕捉,再扩大“战果”;如果没有明显的突破口,先要通过分析,大胆进行联想和猜测,再进行验证。
解无机推断题一般可采用顺向推理法、逆向推理法、演绎法、综合推理法等。解题的关键在于找到突破口(又称“题眼”),通常可从以下途径去寻找突破口:
1.从物质的组成、结构方面寻找
例如:“A≡A”分子必然是N2,不含有化学键的物质一定是稀有气体,具有10电子的分子可能是CH4、NH3、H2O、HF,具有四面体结构的可能是CH4、P4、NH,组成为AB3型的化合物可能为NH3、PCl3、AlCl3等,两种元素以原子个数比为1∶1、1∶2形成的化合物可能是H2O2、H2O和Na2O2、Na2O等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com