
8.往含Fe3+、H+、NO的混合液中加入少量Na2SO3,充分反应后,下列表示该反应的离子方程式正确的是( )
A.2Fe3++SO+H2O===2Fe2++SO+2H+
B.2H++SO===H2O+SO2↑
C.2H++2NO+3SO===3SO+2NO↑+H2O
D.2Fe3++3SO+3H2O===2Fe(OH)3↓+3SO2↑
[解析] 此题看上去似乎4个选项都可能发生,但我们知道氧化还原反应优先于非氧化还原反应,因此B、D不正确。那么SO是先与Fe3+反应还是先与H++NO反应呢?可以用“假设法”进行判断。如果先与Fe3+反应,则生成的Fe2+又会与H++NO反应,所以应先与H++NO反应,故应选C。
[答案] C
7.某稀溶液中含有Fe(NO3)3、Cu(NO3)2和HNO3,若向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为____________________。
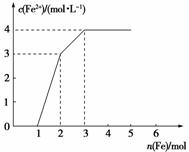
[解析] 氧化性由强到弱的顺序是:HNO3>Fe3+>Cu2+,反应由先到后的顺序为
4HNO3+Fe===Fe(NO3)3+NO↑+2H2O
4mol 1 mol 1 mol
2Fe3++Fe===3Fe2+
2 mol 1 mol 3mol
故原溶液中n[Fe(NO3)3]=2 mol-1 mol=1 mol
Cu2++Fe===Fe2++Cu
1 mol 1 mol 1 mol
故c[Fe(NO3)3]∶c[Cu(NO3)2]∶c(HNO3)=1∶1∶4。
[答案] 1∶1∶4
6.(2014·盐城质检)将足量Cl2缓缓通入含0.02 mol H2SO3和0.02 mol HBr的混合溶液中。在此过程中溶液的pH 与Cl2用量的关系示意图是(溶液体积变化忽略不计,且不考虑Cl2与水反应)( )
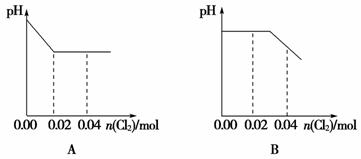

[解析] 因H2SO3的还原性强于HBr的还原性,故Cl2先氧化H2SO3,H2SO3+Cl2+H2O===H2SO4+2HCl,生成的H2SO4和HCl是强酸,故溶液的pH 下降;当H2SO3完全反应后,再通入Cl2,发生反应Cl2+2HBr===Br2+2HCl,溶液的pH不再改变。
[答案] A
5.向NaBr、NaI和Na2SO3混合液中通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体物质的组成可能是( )
A.NaCl、Na2SO4 B.NaBr、Na2SO4
C.NaCl、Na2SO4、I2 D.NaCl、NaI、Na2SO4
[解析] 向NaBr、NaI和Na2SO3混合液中通入一定量氯气后,可能发生的反应依次为:Na2SO3+Cl2+H2O===Na2SO4+2HCl、2NaI+Cl2===2NaCl+I2、2NaBr+Cl2===2NaCl+Br2。将溶液蒸干时HCl、Br2和Cl2会挥发,灼烧时I2会升华。若通入的氯气过量,得到固体剩余物质的组成是NaCl、Na2SO4;若通入的氯气是不足量的,则还有可能留下NaBr。
[答案] A
4.少量的氯气通入FeBr2溶液中,其反应的离子方程式正确的是( )
A.2Br-+Cl2===Br2+2Cl-
B.2Fe2++Cl2===2Fe3++2Cl-
C.2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
D.2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
[解析] 由于还原性:Fe2+>Br-,当Cl2不足时,Fe2+优先反应。
[答案] B
3.向NH4Cl、AlCl3、MgCl2混合溶液中逐滴加入NaOH至过量,按反应的先后顺序,写出有关的离子方程式:
(1)_____________________________________________________,
_______________________________________________________。
(2)____________________________________________________。
(3)____________________________________________________。
[答案] (1)Al3++3OH-===Al(OH)3↓
Mg2++2OH-===Mg(OH)2↓
(2)NH+OH-===NH3·H2O
(3)Al(OH)3+OH-===AlO+2H2O
2.写出在硫酸铝铵溶液中加入少量氢氧化钡溶液的离子方程式:
___________________________________________
___________________________________________。
[解析] 在硫酸铝铵溶液中,存在NH、Al3+与SO,当加入少量的Ba(OH)2溶液后,Ba2+和SO结合生成BaSO4,OH-则既可与Al3+结合又能与NH结合,它们彼此之间发生互相竞争的反应。由在含有Al3+的溶液中滴入NH3·H2O,有白色沉淀生成可知,Al3+结合OH-的能力大于NH结合OH-的能力,OH-优先与Al3+结合生成Al(OH)3,则上述离子方程式为:
2Al3++3SO+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
[答案] 2Al3++3SO+3Ba2++6OH-===
2Al(OH)3↓+3BaSO4↓
1.少量NaOH溶液滴入到NH4HCO3溶液中的离子方程式为_______________________。
[答案] HCO+OH-===H2O+CO
2.同一溶液含有多种还原性物质被氧化的顺序
如:向FeBr2溶液中通入少量Cl2,则反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-。若Cl2过量,则反应的离子方程式为2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-。
 (2014·郑州质检)在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.01
mol的酸性混合溶液中加入 0.01 mol 铁粉,经搅拌后发生的变化应是( )
(2014·郑州质检)在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.01
mol的酸性混合溶液中加入 0.01 mol 铁粉,经搅拌后发生的变化应是( )
A.铁溶解,析出0.01 mol Ag和0.005 mol Cu
B.铁溶解,析出0.01 mol Ag并放出H2
C.铁溶解,析出0.01 mol Ag,溶液中不再有Fe3+
D.铁溶解,析出0.01 mol Ag,溶液中不再有Cu2+
[解析] 因为氧化性Ag+>Fe3+>Cu2+>H+,所以先发生反应2Ag++Fe===2Ag+Fe2+,其中0.005 mol的铁粉与0.01 mol的AgNO3反应,析出0.01 mol Ag,再发生: 2Fe3++Fe===3Fe2+,其中剩余的0.005 mol铁粉与 0.01 mol 的Fe(NO3)3反应,溶液中不再有Fe3+,故选C。
[答案] C
类型3 氧化还原反应、复分解反应混合型
一般情况下,氧化还原反应优先于非氧化还原反应发生。
 写出向漂白粉溶液中通入二氧化硫气体的化学方程式。
写出向漂白粉溶液中通入二氧化硫气体的化学方程式。
[解析] 漂白粉溶液中含有CaCl2和Ca(ClO)2,其中Ca(ClO)2水溶液能与SO2发生反应,向漂白粉溶液中通入二氧化硫气体后,是发生复分解反应生成CaSO3和HClO还是发生氧化还原反应,两反应互相竞争。由于次氯酸盐及次氯酸都具有强氧化性而亚硫酸盐及二氧化硫都具有还原性,所以是发生氧化还原反应而不是复分解反应。
[答案] Ca(ClO)2+2SO2+2H2O===CaSO4↓+2HCl+H2SO4

1.同一溶液含有多种氧化性物质被还原的顺序
如:①将Zn投入含有Fe2+和Cu2+的混合液中,按反应先后,其有关离子方程式为Cu2++Zn===Cu+Zn2+(先)、Fe2++Zn===Fe+Zn2+(后)这是因为氧化能力Cu2+>Fe2+。
②将Fe投入含有Fe3+、Cu2+、H+的混合液中,按反应先后,其反应依次为Fe+2Fe3+===3Fe2+,Fe+Cu2+===Cu+Fe2+,Fe+2H+===Fe2++H2↑。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com