
2.环境保护的措施
(1)工业废气携带颗粒物的回收利用。
(2)工业、生活污水经处理达标后排放,限制使用含磷洗涤剂。
(3)回收、限制难降解塑料,研制可降解塑料。
 环境问题及解决措施
环境问题及解决措施
Ⅰ.臭氧层空洞
高空大气中O2吸收紫外线可变成臭氧(O3),而冰箱中的致冷剂氟里昂在紫外线作用下分解出氯原子,氯原子能加速臭氧的分解,从而破坏平流层中的臭氧层。同样超音速飞机的尾气及发动机尾气中的NO也能加快O3的分解,反应式如下:NO+O3―→NO2+2O;NO2+O―→NO+O2。请你写出总的反应式:_________________;
其中NO的作用是________和________。
[解析] 通过化学反应方程式的加和可以得到总的反应式:O3O2+O。通过第一个反应式可知NO作还原剂,由总反应式可知NO作催化剂。
[答案] O3O2+O 还原剂 催化剂
Ⅱ.水源污染(富营养化)
(1)工、农业及城市生活污水中含磷。家用洗涤剂是污水中磷的一个重要来源(洗涤剂中含有磷酸钠)。关于处理污水时要不要除去磷的说法正确的是( )
A.磷是生物所需的营养元素,不必除去
B.含磷的污水是很好的肥料,不必除去
C.含磷污水排到自然水中引起藻类增殖,使水变质,必须除去
D.磷对人无毒,除去与否都无关紧要
[解析] 含磷的污水是水污染的重要来源之一,这种富含营养元素(N、P等)的污水排入自然水中,会使水中微生物和藻类大量繁殖、生成、腐败,从而使水中的溶解氧大量减少引起水中生物死亡、水质恶化,降低了水的使用价值。
[答案] C
(2)赤潮
我国沿海出现了大面积赤潮,赤潮是红藻、蓝藻等在较短时间内大量繁殖形成的,它造成的严重后果是___________。
赤潮是水体富营养化的结果,主要是因为_________________________________等,
使水中含有大量的________元素对应的离子。为了防止水污染。我国许多地区已经对洗衣粉的成分加以限制,不得再销售含有________(从下述选项中选)的洗衣粉。
A.硅酸钠 B.烷基苯磺酸钠
C.三聚磷酸钠 D.蛋白质
[答案] 藻类分泌毒素,并且消耗水中的溶解氧,造成水质恶化和鱼类死亡 滥用氮肥、磷肥、农药和城镇废水任意排放 氮、磷 C
Ⅲ.酸雨
(1)自然界“酸雨”形成的原因主要是( )
A.未经处理的工业废水的任意排放
B.大气中二氧化碳含量增多
C.工业上大量燃烧含硫的燃料和金属矿石的冶炼
D.汽车排放的尾气和燃料不完全燃烧产生的气体
[解析] 自然界中的酸雨主要是硫酸雨,这是由于大气中SO2和SO3含量过高造成的,形成这种情况的主要原因是工业大量燃烧含硫的燃料和金属矿石的冶炼,汽车尾气的排放不是主要原因。
[答案] C
(2)SO2主要来自于硫酸工厂废气和含硫矿物的燃烧。
①若用Na2SO3溶液来吸收工厂的SO2尾气,加热吸收液可获得高浓度的SO2,变废为宝。你能写出主要的化学方程式吗?
②为除去燃料中的硫,可采用如图脱硫工艺。你能写出主要的化学方程式吗?

[答案] ①SO2+H2O+Na2SO32NaHSO3
②CaO(s)+SO2(g)CaSO3(s),
2CaSO3(s)+O2(g)2CaSO4(s)
Ⅳ.光化学烟雾
大气污染物一氧化氮、二氧化氮和某些碳氢化合物在太阳光的照射下,在低空大气中发生复杂的光化学反应(大气中的氧气也参加了反应),形成白色或浅蓝色有特殊气味的光化学烟雾。
光化学烟雾中主要含二次污染物如醛类、酮类、臭氧、过氧乙酰硝酸酯等。光化学烟雾严重危害人体健康,损害植物及橡胶制品等。
汽车尾气污染:
汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源之一。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO和NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式_______________________________________。
(2)“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是___________________。
(3)控制城市空气污染源的方法可以有________。
A.开发氢能源 B.使用电动车
C.植树造林 D.戴上呼吸面具
[答案] (1)2CO+2NON2+2CO2
(2)SO2转化成SO3,SO3遇水生成硫酸
(3)ABC

一、环境污染及其防治
1.环境污染
与化学相关的环境污染问题主要包括如下几个方面。
一是大气污染问题:这是指由空气中的颗粒物、硫的氧化物(SO2、SO3)、氮的氧化物(NO、NO2等)、CO、碳氢化合物、氟氯代烃等造成的污染(其中SO2、NOx主要来源于化石类燃料的大量使用)。大气污染的具体表现主要有:形成酸雨、酸雾;臭氧层空洞;光化学烟雾;室内空气污染(指家用燃料的燃烧、烹调、吸烟产生的CO、CO2、NO、NO2、SO2等,各种建筑材料和装饰材料释放出的甲醛、苯等有机物造成的污染等;其中CO与血红蛋白作用会使血液失去输氧能力,导致CO中毒)。
二是水体污染:这是指过量有害物质进入水中造成的污染。导致水体污染的物质主要有两大类,一类是重金属污染,如重金属Hg、Cd、Pb、Cr等进入水中形成的污染,这些重金属主要来自于化工、冶金、电子、电镀等排放的工业废水。另一类是植物营养物质污染:水中高浓度的N、P等植物营养物质,导致水体富营养化而形成的污染。它主要是由进入水中腐烂的含蛋白质的物质、含磷洗涤剂及大量使用的磷肥造成的。
三是固体废弃物造成的污染:主要是指生活垃圾、工业废料随意堆放造成的污染。目前最引人注意的是由塑料制品造成的白色污染及废旧电池造成的重金属污染。垃圾污染范围广泛,对环境及生物的不良影响途径多样。

当今环境污染存在以下几方面问题:
(1)酸雨——形成原因主要是SO2和氮氧化合物。
(2)光化学烟雾——主要是氮氧化合物、碳氢化合物造成的。
(3)臭氧空洞——主要是氟氯代烃、氮氧化合物等的排放引起的。
(4)温室效应——主要是由于大气中CO2等的含量的不断增加造成的。
(5)白色污染——聚乙烯等难降解塑料的大量使用。
(6)赤潮——含磷洗衣粉的大量使用,工、农业及城市生活污水的任意排放。
3.
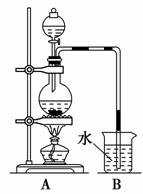
如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验。
(1)A装置中发生化学反应的离子方程式为________________________________。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种成分都有可能。请你设计实验,得出正确结论。
①提出假设
假设一:H2O使布条褪色;
假设二:____________________________________________________;
假设三:___________________________________________________;
假设四:盐酸使布条褪色。
②设计实验方案
基于提出的假设,设计出实验方案(不需要作答)
③实验过程
实验Ⅰ:_____________________________________________________;
实验Ⅱ:______________________________________________________;
实验Ⅲ:把红色布条放在水里,布条不褪色。
④得出结论:_________________________________________________。
(3)用量筒量取20 mL氯水,倒入已检查完好的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞,充分振荡,静置于铁架台上(如图),等分层后取上层液和下层液,呈黄绿色的是________(填“上层液”或“下层液”),再装入如图所示的烧杯中,能使有色布条褪色的是________(填“上层液”或“下层液”)。

(4)这套制取氯水装置的缺点是____________________________________,
请在上面的方框中画出改进部分的实验装置图。
[解析] (1)A装置适合用二氧化锰与浓盐酸共热制取氯气。(2)氯气与水的反应是可逆反应,新制氯水中含有H2O、Cl2、HClO、HCl四种成分,每种成分都可能使有色布条褪色,应据此提出假设。要证明是HClO使有色布条褪色,只需设计实验证明H2O、Cl2、HCl不能使有色布条褪色即可。将有色布条分别放在干燥的氯气中、盐酸中、水中,发现有色布条不褪色,即可证明是氯水中的HClO使有色布条褪色。(3)氯气在水中的溶解度不大,易溶于四氯化碳。在氯水中加入四氯化碳后,四氯化碳萃取了氯气,四氯化碳密度比水大,所以下层液呈黄绿色;上层液中还含有少量的HClO,能使有色布条褪色。(4)在本题制取氯水的实验中,将氯气直接通入盛有水的烧杯中,没有处理尾气的装置,多余的氯气会造成污染。应将氯气通入密闭的洗气瓶中制备氯水,最后还要设置尾气吸收装置。
[答案] (1)MnO2+4H++2Cl-△Mn2++Cl2↑+2H2O
(2)①氯气使布条褪色 HClO使布条褪色
③把红色干布放入充满干燥氯气的集气瓶中,布条不褪色 把红色布条伸入稀盐酸中,红色布条不褪色
④次氯酸使布条褪色
(3)下层液 上层液
(4)没有处理尾气,会造成环境污染 改进部分如下图所示(或其他合理方案,原理、试剂、密封均正确才可)

4.实验装置图的画法举例——氯气的实验室制法

 已知A、B、D、E、F、G为中学化学中常见的化合物,它们之间有如图所示的转化关系(反应条件及部分产物已略去)。A为绿色粉末,含H、C、O、Cu四种元素。常温下,D为无色无味气体,B为黑色粉末,E分子结构中含有醛基。
已知A、B、D、E、F、G为中学化学中常见的化合物,它们之间有如图所示的转化关系(反应条件及部分产物已略去)。A为绿色粉末,含H、C、O、Cu四种元素。常温下,D为无色无味气体,B为黑色粉末,E分子结构中含有醛基。

请回答下列问题:
(1)D跟G反应的化学方程式为________________________________________________________________________。
(2)F中一定含有的官能团名称为________。
(3)某课外小组设计了下列实验装置,通过测定装置甲和装置乙中试剂的质量变化,探究A的化学式。
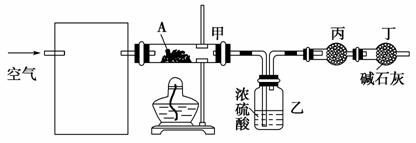
①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称。
②向装置中鼓入空气的目的是______________________________________________;
丙装置中药品的名称是________,实验时,该药品未见明显变化,证明___________________。
③如何判断A已完全分解?_________________________________________________。
④通过实验,得出如下数据:A受热后完全分解,固体由8.0 g变为6.0 g,装置乙增重0.9 g。写出A的化学式:_______(表示为碱式盐)。
[解析] 结合A中所含元素和A加热分解产物的特点可确定B、D分别为CuO和CO2,根据E中含有醛基,则F为醇类,其中一定含有羟基,结合D→O2的反应可确定G为Na2O2。(3)鼓入空气是为了将加热后A分解产生的水蒸气全部赶入盛有浓硫酸的洗气瓶,以测量生成水的质量,故方框中需用盛有浓硫酸或碱石灰的干燥装置除去空气中的水蒸气。④完全分解后A中剩余6.0 g CuO,乙中增加0.9 g H2O,根据质量守恒可确定生成1.1 g CO2,由此可确定生成物中CuO、H2O和CO2的物质的量分别为0.075 mol、0.05 mol和0.025 mol,由A为碱式盐,可确定A为Cu3(OH)4CO3或CuCO3·2Cu(OH)2。
[答案] (1)2Na2O2+2CO2===2Na2CO3+O2
(2)羟基
(3)
②将A分解产生的水蒸气送入盛有浓硫酸的洗气瓶中 无水硫酸铜 A分解产生的水蒸气全部被浓硫酸吸收
③连续两次加热、鼓气、冷却,称量甲装置的质量,质量差不超过0.1 g
④Cu3(OH)4CO3或CuCO3·2Cu(OH)2

3.实验装置图的绘制方法
许多实验都是由多种仪器组装串连而成的,这类图形较单仪器绘制难度大,但只要掌握了绘制方法程序,画起来还是得心应手的。实验装置图绘制的方法程序是“一定位置二绘图,三画连接四修补”。
(1)整体图形的布局。在画图之前,必须对实验装置实物造型心中有数,绘制时,以水平线为基准,画出确定上下左右仪器位置的辅助线。仪器位置直接影响着图形的美观,各仪器离得太远,图形显得松散,离得太近又显得拥挤,所以定位置是绘制的关键。
(2)绘分仪器图。采取上述任意一种画法,画出各仪器的图形,绘制时应注意同一图面上各仪器间的大小配套与协调统一。
(3)画连接部分。最基本的连接仪器有带导管的塞子,玻璃导管、乳胶管等,通过连接使整个装置图浑然一体。
(4)修饰补正。草图框架轮廓成形后,进行药品填充,现象标明,线条描实等细节绘制,使整个图形尽量达到完美无缺。
2.组合正确,画面整洁
在绘制化学实验装置图时,要能体现所有的各种仪器和连接部件组装正确,布局合理,使用科学。在同一图形中,各种仪器的绘制线条粗细应一致,画面要洁净,并能清楚地反映出各种仪器的特征形象。
二、化学实验装置图绘制的基本要求
1.仪器造型科学规范,比例合适
常用仪器造型要科学,画法要形象、规范。整个化学实验装置图中所绘制的各种仪器大小比例要合适,同一仪器各部分的大小比例亦要合适。
2.下列实验装置及操作正确的是( )

[解析] A项,缺少浓硫酸,试管可直接加热且试管应倾斜45°;B项,两池中电解质溶液应互换;C项,反应产生的SO2气体也能使溴水褪色,故不能检验是否有乙烯产生。
[答案] D
1.如图各装置不能达到实验目的的是( )
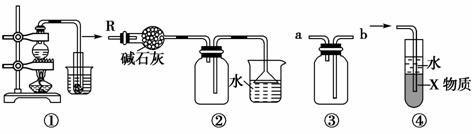
A.装置①可制取少量蒸馏水
B.装置②可用于干燥、收集氨气,并吸收多余的氨气
C.装置③可用于排空气法收集H2、CO2、Cl2、HCl、NO等气体
D.装置④中X物质若为四氯化碳,则可用于吸收氨气或氯化氢,并防止倒吸
[解析] 选项A,加热水生成水蒸气然后在烧杯中冷却得到蒸馏水。选项B,NH3可用碱石灰干燥,由于NH3的密度比空气小,所以收集装置正确,NH3极易溶于水,所以通过倒置的漏斗可吸收多余的氨气。选项C,NO不能用排空气法收集。选项D,由于NH3或HCl不能溶解在四氯化碳中,气体通过四氯化碳能使气体均匀分散被H2O吸收,从而防止倒吸。
[答案] C
3.实验操作是否正确
该方面则主要以图的形式,直观体现实验操作,通过仪器间位置关系、读数时视线角度等设置问题。如集气(洗气)时气体的出入、读数时视线高低、是否有尾气处理等。
 用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
|
A |
B |
C |
D |
 |
 |
 |
 |
|
干燥氯气 |
吸收NH3 |
石油的分馏 |
制取乙酸乙酯 |
[解析] 干燥氯气时,通过洗气瓶的导管应是长管进、短管出,A错;分馏石油时,温度计的水银球应位于蒸馏烧瓶支管口处,C错;制取乙酸乙酯时,应选择饱和Na2CO3溶液分离乙酸乙酯,D错。
[答案] B

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com