
25.(15分)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
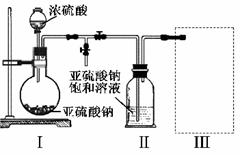
(1)装置I中产生气体的化学方程式为 。
(2)要从装置II中获得已析出的晶体,可采取的分离方法是 。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3- 的电离程度大于水解程度,可采用的实验方法是 (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是 。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
24. (15分)铁及其化合物与生产、生活关系密切。
(15分)铁及其化合物与生产、生活关系密切。
(1)右图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤II中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
23.(15分)元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②II中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。

①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
12.在一定条件下,N2O分解的部分实验数据如下:

下图能正确表示该反应有关物理量变化规律的是
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)

第II卷
11.某原电池装置如右图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
A.正极反应为AgCl +e-=Ag +Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子

10.下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是
A.溶质的电离方程式为NaHCO3=Na++ H++ CO32 -
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3- )+c(CO32 -)
D.温度升高,c(HCO3- )增大
9.常温下,下列各组物质中,Y既能与X反应又能与Z反应的是

A.①③ B.①④ C.②④ D.②③
8.下列实验能达到目的的是
A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
7.下列关于乙醇的说法不正确的是
A.可用纤维素的水解产物制取 B.可由乙烯通过加成反应制取
C.与乙醛互为同分异构体 D.通过取代反应可制取乙酸乙酯
6.下列有关物质应用的说法正确的是
A.生石灰用作食品抗氧剂 B.盐类都可作调味品
C.铝罐可久盛食醋 D.小苏打是面包发酵粉的主要成分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com