
1.《中华人民共和国食品安全法》已公布,将于今年6月1日起实施。下列做法符合食品安全要求的是 -----------------------( )
A.加工香肠时加入亚硝酸钠以保持肉类新鲜[来源:]
B.在食盐中加适量的乳酸锌以防止儿童缺锌
C.制作膨化食品时需加入过量的膨松剂硫酸铝铵
D.用福尔马林(甲醛溶液)浸泡海产品使其长时间保鲜
18.(1)0.02mol·L—1·min—1
(2)减小压强 1.0mol 0.84 K1=K2=K3=K4<K5
 (3)2A(g)+B(g) 3C(g);△H=+200aKJ·mol-1
(3)2A(g)+B(g) 3C(g);△H=+200aKJ·mol-1
9.(19分)
⑴加成反应 消去反应 取代反应
⑵
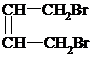 +2NaOH →
+2NaOH → 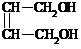 +2NaBr
+2NaBr
⑶ ③; 保护A分子中C=C不被氧化 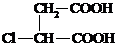
(1)C6H6
(2)碳碳双键 酯基
(3)
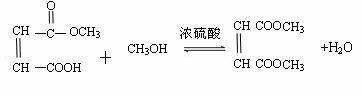
(4)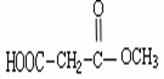 ;
;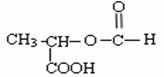
8.(17分)

10.(14分)向一体积不变的密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如附图一所示。附图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变 一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。
一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。
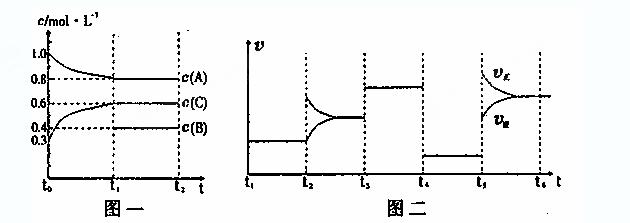
(1)若t1=15min,则t0-t1阶段以 C浓度变化表示的反应速率为v(C)=
。
C浓度变化表示的反应速率为v(C)=
。
(2)t4-t5阶段改变的条件为
,B的 起始物质的量为
。各阶段平衡时对应的平衡常数如下表所示:
起始物质的量为
。各阶段平衡时对应的平衡常数如下表所示:
|
t1—t2 |
t2—t3 |
t3—t4 |
t4—t5 |
t5—t6 |
|
K1 |
K2 |
K3 |
K4[来源:Z。X。X。K] |
K5 |
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接)
(3)t5—t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式
。

 (3)3Fe+4H2O
(3)3Fe+4H2O Fe3O4+4H2↑
(4)Al+ Fe3O4 Fe+ Al2O3 铝热
(5)2Al+2OH—+2H2O 2AlO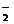 +3H2↑
+3H2↑
(6)4Fe(OH)2+O2+2H2O 4Fe(OH)3
9.(19分)以石油 裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制
裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制 造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
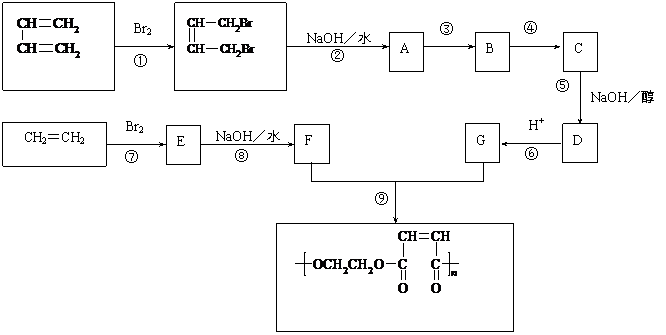
请按要求填空:
⑴写出下列反应的反应类型:
反应①
,反应⑤
 ,反应⑧
。
,反应⑧
。
⑵反应②的化学方程式是 。
⑶反应③、④中有一反应是与HCl加成,该反应是________(填反应编号)
设计这一步反应的目的是_____________________________
物质C的结构简式_____________________________
顺丁烯二酸二甲酯是一种重要的有机化工原料,广泛应用于涂料,油漆,杀虫剂尤其是在水处理剂等方面。下面是利用石油产品M合成顺丁烯二酸二甲酯的部分过程

(1)已知烃M的相对分子质量为78,分子内含碳量为92.3%,所有C—H键和碳碳键类型相同,化合物M的化学式为
(2)中间产物A含有的官能团为 (填名称)
( 3)写出由中间产物A合成顺丁烯二酸二甲酯的方程式
(4)中间产物A和足量的H2反应后,可得有机物B(C4H10O4),写出B属于酯类的可能结构简式
8.(17分)聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
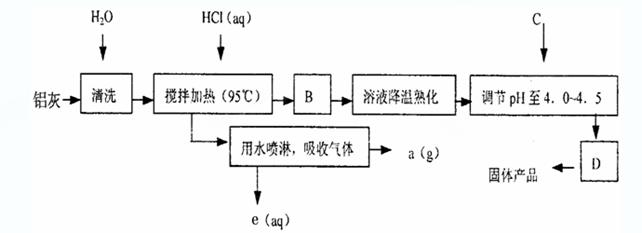 (1)搅拌加热操作过程中发生反应的离子方程式为:
(1)搅拌加热操作过程中发生反应的离子方程式为:
; 
(2)生产过程中B和D的操作名称分别是 和
(B和D均为简单操作)。
(3)反应中副产品a是 。
(4)生产过程中可循环使用的物质是 (用化学式表示)。
( 5) 调节pH至4.0-5.0的目的是  。
。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到
的晶体较纯净。生产过程C物质可选用 。
A.NaOH B.Al C.氨水 D. Al2O3 E.NaAlO2
Al2O3 E.NaAlO2
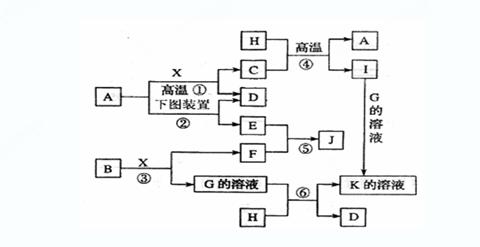
7.(14分)已知:A、H为常见的金属单质,D、F在常温下为气态单质,B为淡黄色固体,J为红褐色沉淀。请按要求填空:
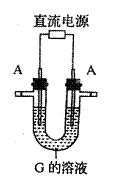 (1)写出B的电子式: 。
(1)写出B的电子式: 。
(2)写出用A作电极电解G溶液(如右图),在电极上生成E的反
应式 。
(3)反应①的化学方程式是 。
( 4 )反应④的化学方程式是 。
其在生产中有重要应用,被称为 反应。
(5)反应⑥的离子方程式是
|
( 6 )反应⑤ 的化学 方程式
方程式
|
6.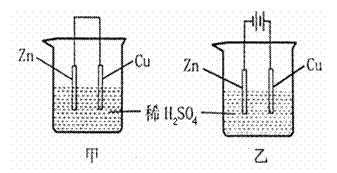 关于如图所示装置的叙述正确的是 ( )
关于如图所示装置的叙述正确的是 ( )
A.甲乙装置中的锌片都作负极
B.甲乙装置中的溶液内的H+在铜片上被还原
C.甲乙装置中锌片上发生的反应都是还原反应
D.甲装 置中铜片上有气泡生成,乙装置中的铜片质量减小
置中铜片上有气泡生成,乙装置中的铜片质量减小
第Ⅱ卷
本题共4题,共64分
5.设NA表示阿伏加德罗常数的值,下列叙述中正确的是 ( )
A.常温常压下,8.8gCO2和N2O的混合物中所含有的原子数为0.6NA
B.Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6NA
C.标准状况下,3.36L丁烷中含有的碳碳键数为0.6NA
D.在1L 0.2mol·L-1的硫酸铁溶液中含有的铁离子数为0.6NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com