
12.(2011山东高考29,14分)科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为 。要清洗附着在试管壁上的硫,可用的试剂是 。
(2)下图为钠硫高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+ S=Na2
S=Na2 ,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 倍。
,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 倍。
 (3)Na2S溶液中离子浓度由大到小的顺序为
,向该溶液中加入少量固体CuSO4,溶液PH
(3)Na2S溶液中离子浓度由大到小的顺序为
,向该溶液中加入少量固体CuSO4,溶液PH
(填“增大”“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为 (用离子方程式表示)。
11.(2011山东高考28,14分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为
。利用反应6NO2+ 8NH3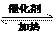 7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g)
ΔH=-196.6 kJ·mol-1
2SO3(g)
ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g)
ΔH=-113.0
kJ·mol-1
2NO2(g)
ΔH=-113.0
kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
 (3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
10.(2011福建高考23,15分)
I、磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10 10C+P4O10===P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是__________mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
|
|
0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol·L-1Na2SO3溶液的体积/mL |
H2O的体积/mL |
实验温度 /℃ |
溶液出现蓝色时所需时间/s |
|
实验1 |
5 |
V1 |
35 |
25 |
|
|
实验2 |
5 |
5 |
40 |
25 |
|
|
实验3 |
5 |
5 |
V2 |
0 |
|
该实验的目的是_____________________;表中V2=___________mL
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
□Ce3++□H2O2+□H2O === □Ce(OH)4↓+□_______
9.(2011浙高考26,15分)食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性:
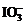 >Fe3+>I2;还原性:
>Fe3+>I2;还原性: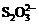 >I-;3I2+6OH-
>I-;3I2+6OH-
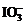 +5I-+3H2O;KI+I2
+5I-+3H2O;KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是_________(用化学式表示);CCl4中显紫红色的物质是___________________(用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为___________________________、______________________________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
写出潮湿环境下KI与氧气反应的化学方程式:_____________________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由________________________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是___________________。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+: 。
8.(2011江苏高考16)(12分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为SO2+O2 SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
。
SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
7、解析:若碳酸钠恰好与盐酸反应生成碳酸氢钠,则盐酸的浓度是1.0 mol/L;若碳酸钠恰好与盐酸反应生成二氧化碳,则盐酸的浓度是2.0 mol/L。由于最终生成的气体体积不同,所以只能是介于二者之间。
答案:B
7.(201上海17)120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
A.2.0mol/L B.1.5 mol/L C.0.18 mol/L D.0.24mol/L
6、解析:A生成BaSO3沉淀;SO2溶于水显酸性,被Ba(NO3)2氧化生成硫酸,进而生成BaSO4沉淀;SO2通入Na2S溶液中会生成单质S沉淀。
答案:D
6.(2011上海7)下列溶液中通入SO2一定不会产生沉淀的是
A. Ba(OH)2 B. Ba(NO3)2 C. Na2S D. BaCl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com