
3、解析:本题考察离子共存问题。SiO32-属于弱酸硅酸的酸根与酸不能大量共存,同时在酸性溶液中,NO3―具有氧化性能氧化I―生成单质碘,A不正确;Ag+与Cl―和SO42―均可生成难溶性物质AgCl和Ag2SO4,B不正确;在碱性溶液中NH4+和HCO3-均与OH-结合分别形成氨水和CO32-,因此D也不正确,所以答案是C。
答案:C
3. (2011广东高考8)能在水溶液中大量共存的一组离子是 ( )
A. H+、I―、NO3―、SiO32-  B.
Ag+、Fe3+、Cl―、SO42―
B.
Ag+、Fe3+、Cl―、SO42―
C.K+、SO42-、Cu2+、NO3― D.NH4+、OH-、Cl-、HCO3-
2、解析:饱和氯水具有强氧化性,能将SO32-氧化成SO42-,A中不能大量共存;c(H+)=1.0×10-13mol/L溶液,说明该溶液显碱性,因此可以大量共存;S2-和Cu2+可以结合生成难溶性CuS沉淀,所以不能大量共存;pH=12的溶液,说明该溶液显碱性,而Al3+与碱不能大量共存。所以正确的答案是B。
答案:B
2.(2011安徽高考8)室温下,下列各组离子在指定溶液中能大量共存的是 ( )
A.饱和氯水中 Cl-、NO3-、Na+、SO32-
B.c(H+)=1.0×10-13mol/L溶液中 C6H5O-、K+、SO42-、Br-
C.Na2S溶液中 SO42-、 K+、Cl-、Cu2+
D.pH=12的溶液中 NO3-、I-、Na+、Al3+
1、解析:本题以溶液中离子共存的方式考查学生对硝酸的氧化性、亚铁离子还原性、甲基橙呈红色水溶液的呈酸性、酸性溶液AlO2-不能在其中共存、与铝反应产生大量氢气有强酸碱性两种可能等相关知识的理解程度,考查学生综合运用所学化学知识解决相关化学问题的能力。
答案:C
1.(2011江苏高考4)常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
12、解析:(1)乙醇中还有羟基可以与金属钠反应放出氢气,化学方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;单质硫不溶于水,微溶于酒精,易溶液CS2,在加热时可与热的氢氧化钠溶液反应,因此要清洗附着在试管壁上的硫,可选用CS2或热的氢氧化钠溶液;
(2)由电池反应可与看出金属钠失去电子作为负极,单质硫得电子被还原成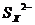 ,所以正极的电极反应式为XS+2e-=
,所以正极的电极反应式为XS+2e-=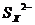 ;由于原电池内部要靠离子得定向运动而导电,同时钠和硫极易化合,所以也必需把二者隔离开,因此其作用是离子导电(导电或电解质)和隔离钠与硫;在铅蓄电池中铅作负极,反应式为Pb(s)+SO42-(aq)-2e-=PbSO4(s),因此当消耗1mol即207g铅时转移2mol电子,而207g钠可与失去的电子数为
;由于原电池内部要靠离子得定向运动而导电,同时钠和硫极易化合,所以也必需把二者隔离开,因此其作用是离子导电(导电或电解质)和隔离钠与硫;在铅蓄电池中铅作负极,反应式为Pb(s)+SO42-(aq)-2e-=PbSO4(s),因此当消耗1mol即207g铅时转移2mol电子,而207g钠可与失去的电子数为 ,所以钠硫电池的理论放电量是铅蓄电池的9/2=4.5倍。
,所以钠硫电池的理论放电量是铅蓄电池的9/2=4.5倍。
(3)Na2S属于强碱弱酸盐S2-水解显碱性,所以c(H+)最小。但由于水解程度很小,大部分S2-还在溶液中。因为氢硫酸属于二元弱酸,所以S2-水解时分两步进行且以第一步水解为主,方程式为S2-+H2O=HS-+OH-、HS-+H2O=H2S+OH-,因此Na2S溶液中离子浓度由大到小的顺序为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);由于S2-极易与Cu2+结合形成CuS沉淀而抑制S2-水解,因此溶液但碱性会降低,酸性会增强,方程式为S2-+Cu2+=CuS↓。S2-处于最低化合价-2价,极易失去电子而被氧化,空气中含有氧气可氧化S2-而生成单质硫,方程式为2S2-+O2+2H2O=2S↓+4OH-。
答案:(1)2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;CS2或热的氢氧化钠溶液;
(2)XS+2e-=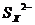 ;离子导电(导电或电解质)和隔离钠与硫;4.5;
;离子导电(导电或电解质)和隔离钠与硫;4.5;
(3)(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);减小;2S2-+O2+2H2O=2S↓+4OH-。
11、解析:(1)NO2溶于水生成NO和硝酸,反应的方程式是3NO2+H2O=NO+2HNO3;在反应6NO+ 8NH3 7N5+12 H2O中NO2作氧化剂,化合价由反应前的+4价降低到反应后0价,因此当反应中转移1.2mol电子时,消耗NO2的物质的量为
7N5+12 H2O中NO2作氧化剂,化合价由反应前的+4价降低到反应后0价,因此当反应中转移1.2mol电子时,消耗NO2的物质的量为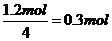 ,所以标准状况下的体积是
,所以标准状况下的体积是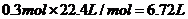 。
。
 (2)本题考察盖斯定律的应用、化学平衡状态的判断以及平衡常数的计算。① 2SO2(g)+O2(g)
(2)本题考察盖斯定律的应用、化学平衡状态的判断以及平衡常数的计算。① 2SO2(g)+O2(g) 2SO3(g) ΔH1=-196.6 kJ·mol-1 ② 2NO(g)+O2(g)
2SO3(g) ΔH1=-196.6 kJ·mol-1 ② 2NO(g)+O2(g) 2NO2(g) ΔH2=-113.0 kJ·mol-1 。②-①即得出2NO2(g)+2SO2(g)
2NO2(g) ΔH2=-113.0 kJ·mol-1 。②-①即得出2NO2(g)+2SO2(g) 2SO3(g)+2NO(g) ΔH=ΔH2-ΔH1=-113.0 kJ·mol-1 +196.6 kJ·mol-1=+83.6 kJ·mol-1。所以本题的正确答案是41.8;反应NO2(g)+SO2(g)
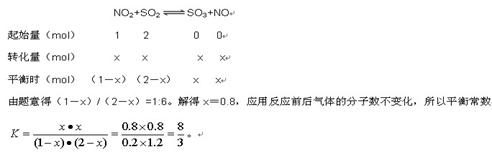
2SO3(g)+2NO(g) ΔH=ΔH2-ΔH1=-113.0 kJ·mol-1 +196.6 kJ·mol-1=+83.6 kJ·mol-1。所以本题的正确答案是41.8;反应NO2(g)+SO2(g) SO3(g)+NO(g)的特点体积不变的、吸热的可逆反应,因此a不能说明。颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,因此b可以说明;SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,c不能说明;SO3和NO2一个作为生成物,一个作为反应物,因此在任何情况下每消耗1 mol SO3的同时必然会生成1 molNO2,因此d也不能说明;设NO2的物质的量为1mol,则SO2的物质的量为2mol,参加反应的NO2的物质的量为xmol。
SO3(g)+NO(g)的特点体积不变的、吸热的可逆反应,因此a不能说明。颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,因此b可以说明;SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,c不能说明;SO3和NO2一个作为生成物,一个作为反应物,因此在任何情况下每消耗1 mol SO3的同时必然会生成1 molNO2,因此d也不能说明;设NO2的物质的量为1mol,则SO2的物质的量为2mol,参加反应的NO2的物质的量为xmol。
(3)由图像可知在相同的压强下,温度越高CO平衡转化率越低,这说明升高温度平衡向逆反应方向移动,因此正反应是放热反应;实际生产条件的选择既要考虑反应的特点、反应的速率和转化率,还要考虑生产设备和生产成本。由图像可知在1.3×104kPa左右时,CO的转化率已经很高,如果继续增加压强CO的转化率增加不大,但对生产设备和生产成本的要求却增加,所以选择该生产条件。
答案:(1)3NO2+H2O=NO+2HNO3;6.72 (2)-41.8;b;8/3;
(3)< 在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失。
10、解析:(1)P属于第15号元素,其原子的结构示意图为: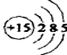 ;
;
(2)每生成1 mol P4时,P由+5价变成0价,电子转移为5×4=20或C化合价由0价变成为+2价,电子转移为2×10=20;
(3)n(Na2S2O3)=bV1/1000 mol;与其反应的I2为bV1/2000 mol,与维生素C反应的I2为 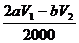 mol,即维生素C的物质的量是
mol,即维生素C的物质的量是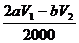 mol(或其它合理答案);
mol(或其它合理答案);
(4)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系。
(5)题目中给出:“加热条件下CeCl3易发生水解”,可知NH4Cl的作用是肯定是抑制水解的,CeCl3水解会生成HCl,可以完整答出:NH4Cl的作用是分解出HCl气体,抑制CeCl3水解。
(6)根据题意:“强酸性”或观察方程式可知缺项是H+,利用电子得失守恒或观察法就可以配平方程式。2Ce3++H2O2+6H2O=== 2Ce(OH)4↓+6H+
答案:(1) ; (2)20; (3)
; (2)20; (3)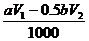 ;
;
(4)探究该反应的速率与温度、亚硫酸钠溶液浓度的关系(或其他合理答案);
(5)分解出HCl气体,抑制CeCl3的水解(或其他合理答案);
(6)2Ce3++H2O2+6H2O=== 2Ce(OH)4↓+6H+。
9、解析:(1)①Fe3+与SCN-的配合产物有多种,如 、
、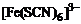 等;I2的CCl4溶液显紫红色。②应用信息:“氧化性:
等;I2的CCl4溶液显紫红色。②应用信息:“氧化性: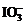 >Fe3+>I2”,说明
>Fe3+>I2”,说明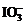 和Fe3+均能氧化I-生成I2。
和Fe3+均能氧化I-生成I2。
(2)KI被潮湿空气氧化,不能写成I-+O2+H+→,要联系金属吸氧腐蚀,产物I2+KOH似乎不合理(会反应),应考虑缓慢反应,微量产物I2会升华和KOH与空气中CO2反应。
KI3·H2O作加碘剂问题,比较难分析,因为KI3很陌生。从题中:“低温条件下可制得”或生活中并无这一使用实例来去确定。再根据信息:“KI+I2 KI3”解析其不稳定性。
KI3”解析其不稳定性。
(3)根据信息“还原性: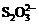 >I-”可判断A;C比较难分析,应考虑食盐潮解主要是Mg2+、Fe3+引起,加Na2CO3能使之转化为难溶物;D中NaNO2能氧化I―。
>I-”可判断A;C比较难分析,应考虑食盐潮解主要是Mg2+、Fe3+引起,加Na2CO3能使之转化为难溶物;D中NaNO2能氧化I―。
(4)实验方案简答要注意规范性,“如取…加入…现象…结论…”,本实验I―对Fe2+的检验有干扰,用过量氯水又可能氧化SCN-,当然实际操作能判断,不过对程度好的同学来说,用普鲁士蓝沉淀法确定性强。
答案:(1)①Fe(SCN)3 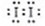
②IO3-+5I-+6H+=3I2+3H2O 2Fe3++2I-=2Fe2++I2
(2)O2+4I-+2H2O=2I2+4KOH
否 KI3在受热(或潮湿)条件下产生I2和KI,KI被氧气氧化,I2易升华。
(3)AC
(4)取足量该加碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如:氯水、过氧化氢等),再滴加KSCN溶于,若显血红色,则该加碘盐中存在Fe2+。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com