
2.(2011安徽高考12)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是:
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D. AgCl是还原产物
解析:由电池总反应可知银失去电子被氧化得氧化产物,即银做负极,产物AgCl是氧化产物,A、D都不正确;在原电池中阳离子在正极得电子发生还原反应,所以阳离子向电池的正极移动,C错误;化合物Na2Mn5O10中Mn元素的化合价是+18/5价,所以每生成1 mol Na2Mn5O10转移电子的物质的量为(4-18/5)×5=2mol,因此选项B正确。
答案:B
1.(2011浙江高考10)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是

A.液滴中的Cl―由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- 4OH-
4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e- Cu2+
Cu2+
解析:液滴边缘O2多,在碳粒上发生正极反应O2+2H2O+4e- 4OH-。液滴下的Fe发生负极反应,Fe-2e-
4OH-。液滴下的Fe发生负极反应,Fe-2e- Fe2+,为腐蚀区(a)。
Fe2+,为腐蚀区(a)。
A.错误。Cl-由b区向a区迁移
B.正确。
C.错误。液滴下的Fe因发生氧化反应而被腐蚀。
D.错误。Cu更稳定,作正极,反应为O2+2H2O+4e- 4OH-。
4OH-。
答案:B
[评析]本题考察电化学内容中金属吸氧腐蚀的原理的分析。
老知识换新面孔,高考试题,万变不离其宗,关键的知识内容一定要让学生自己想懂,而不是死记硬背。学生把难点真正“消化”了就可以做到一通百通,题目再怎么变换形式,学生也能回答。
14.(2011海南,20分)
20-I(6分)下列叙述正确的是
A.“接触法”制H2SO4时,催化氧化阶段的反应原理为
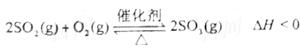
B.海水提镁的主要步骤为
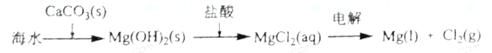
C.普通水泥的主要成分是硅酸钙
D.黏土的主要成分是三氧化二铝
[答案]AC
命题立意:化学工业相关基础知识与流程工艺考查
解析:A为接触法制硫酸的基本原理;B镁工业先期加入的是石灰不是石灰石,后期电解的也不是氯化镁溶液;C普通水泥的成分为硅酸二钙、硅酸三钙、铝酸三钙,说主要成分是硅酸钙正确;黏土的主要成分是二氧化硅,还有氧化镁、碳酸钙和三氧化二铝。
[思维拓展]这类题考查的是化学与技术模块的主要基础知识点,以常见的原料和生产工艺为载体,所以平时的学习中要突出学习的重点,对教材中常见的知识内容了如指掌。
20-II(14分)工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为___________;
②硫酸钠和焦炭、石灰石反应的化学方程式为___________(已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
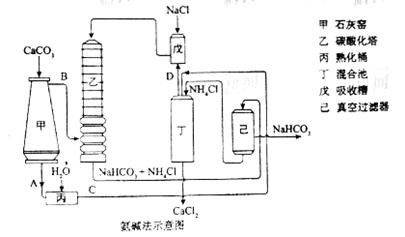
①图中的中间产物C是_______,D_______。(写化学式);
②装置乙中发生反应的化学方程式为_______;
(3)联合制碱法对氨碱法的改进,其优点是______________;
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?__________。

[答案](1)①2NaCl+ H2SO4(浓) Na2SO4 + 2 HCl↑
Na2SO4 + 2 HCl↑
②Na2SO4
+ 4C + CaCO3  CaS
+ Na2CO3 + 4CO
CaS
+ Na2CO3 + 4CO
或Na2SO4 + 2C + CaCO3  CaS + Na2CO3 + 2CO2
CaS + Na2CO3 + 2CO2
(2)①Ca(OH)2 ,NH3;②NH3 + CO2 +NaCl +H2O = NaHCO3 + NH4 Cl
(3)保留了氨碱法的优点,使食盐的利用率提高到96%;NH4Cl可做氮肥;可与合成氨厂联合,原料气氨气和一氧化碳都由氨厂提供,减少CaCO3 制 CO2 这一工序,降低了能耗与污染。
(4)不可行,因为碳酸氢钾溶解度较大,且在常温下与氯化钾的溶解度差别小,在氨盐水碳酸化时无法大量析出。
命题立意:联合制碱工业的考查,主要考查联合制碱法在利用原材料、降低成本、减少污染等方面的工业典范
解析:(1)是考查工业生产中的基本原理;(2)是生产过程中工艺的考查,在细读生产工艺图中各物质的变化后,可得出;(3)考查对教材知识的掌握情况;(4)分析图可看出NaHCO3与新信息KHCO3在溶解度图中的差别,可推测溶解度的差别是判断的依据。
[思维拓展]重要的几种化学工业生产是《化学与技术》模块的核心,所有高考中的考查都以这些生产过程中的原理、生产工艺与设计新思路为依据。所以在备考过程中,要熟练掌握相关的思想、知识细节、生产原理、工艺设计原理,还有新时期对化学工业原理的新要求,如循环经济、原子经济、节能环保等方面的要求在工业中的运用。
13.(2011新课标全国)
普通纸张的成分是纤维素,在早期的纸张生产中,常采用纸表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______。为防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为______。
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等,这样操作产生的主要问题是______。
②喷洒Zn(C2H5)2。Zn(C2H5)2可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______。
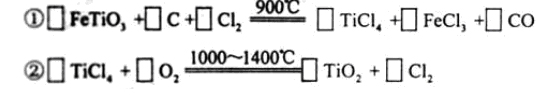
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾,钛白粉的一种工业制法是以钛铁矿主要成分(FeTiO3)为原料按下过程进行的,请完成下列化学方程式
解析:(1)因为明矾中含有Al3+,而Al3+水解显酸性,在酸性条件下纤维素会发生水解使高分子链断裂;由于碳酸钙会消耗氢离子而降低溶液的酸性,从而防止纤维素水解,方程式为CaCO3+2H+=Ca2++H2O+CO2↑;
(2)①因为纤维素在碱性条件下也会发生水解,同样会造成书籍的污损;
②根据产物可以写出该反应的化学方程式Zn(C2H5)2+ H2O=ZnO+2C2H6↑。因为ZnO也可
以消耗氢离子,所以也能防止酸性腐蚀,方程式为ZnO+2H+=Zn2++H2O。
(3)考察氧化还原方程式的配平,依据电子得失守恒可以配平。
答案:(1)明矾水解产生酸性环境,在酸性条件下纤维素水解,使高分子链断裂;CaCO3+2H+=Ca2++H2O+CO2↑;
(2)①过量的碱同样可能会导致纤维素水解,造成书籍污损;
②Zn(C2H5)2+ H2O=ZnO+2C2H6↑、ZnO+2H+=Zn2++H2O;
(3)2 6 7 2 2 6; 1 1 1 2
12.(2011山东高考31,8分)
水处理技术在生产、生活中应用广泛。
(1)含有较多 离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为 (写出一个即可)。
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过
(填“RH”或“ROH”)型离子交换树脂,原因是 。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为 。电渗析法净化水时,使离子通过半透膜的推动力是 。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的 。
解析:(1)通常按水中Ca2+、Mg2+的多少,把天然水分为硬水和软水。含有较多Ca2+、Mg2+的水叫做硬水;如果水的硬度是由Ca(HCO3)2或Mg(HCO3)2所引起的,这种硬度叫做暂时硬度。具有暂时硬度的水可以用加热的方法进行软化,方程式为Ca2++2HCO3- CaCO3↓+CO2↑+H2O、Mg2++2HCO3-
CaCO3↓+CO2↑+H2O、Mg2++2HCO3- MgCO3↓+CO2↑+H2O;
MgCO3↓+CO2↑+H2O;
(2)如果水的硬度是由钙和镁的硫酸盐或氯化物等引起的,这种硬度叫做永久硬度。具有永久硬度的水可以采用离子交换法进行软化。离子交换剂中阳离子与水中的Ca2+、Mg2+发生离子交换作用,使水得到净化。如果硬水先通过ROH型阴离子交换树脂时可能产生Mg(OH)2等沉淀而影响交换效果,所以先通过RH型阳离子交换树脂。
(3)电渗析法是一种利用离子交换膜进行海水淡化的方法。在外加电场的作用下,水溶液中阴、阳离子会分别向两极移动,如果在中间加上一种交换膜,就可能达到分离浓缩的目的。所以电渗析法净化水时,使离子通过半透膜的推动力是电势差或电场力。
(4)因为水的电离程度极小,所以纯水是几乎不导电的,因此要检验蒸馏水的纯度时,最简单易行的方法是测定水的电导率或电阻率。
答案:(1)Ca2+、Mg2+;Ca2++2HCO3- CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O
或Mg2++2HCO3- MgCO3↓+CO2↑+H2O;
MgCO3↓+CO2↑+H2O;
(2)RH;先通过阴离子交换树脂时可能产生Mg(OH)2等沉淀而影响交换效果;
(3)反渗透法;电势差或电场力;
(4)电导率或电阻率。
11.(2011上海)从光合作用的反应原理6CO2+6H2O C6H12O6+6O2可知碳是农作物生长的必需元素之一。关于用二氧化碳生产肥料的评价正确的是
C6H12O6+6O2可知碳是农作物生长的必需元素之一。关于用二氧化碳生产肥料的评价正确的是
A.缓解地球温室效应,抑制农作物营养平衡
B.加剧地球温室效应,促进农作物营养平衡
C.缓解地球温室效应,促进农作物营养平衡
D.加剧地球温室效应,抑制农作物营养平衡
解析:二氧化碳生产肥料,可以消耗二氧化碳,故可以缓解温室效应。
答案:C
10.(2011上海)下列离子在稳定人体血液的pH中起作用的是
A. Na+ B. HCO3- C. Fe2+ D. Cl-
解析:HCO3-既能与酸反应,又能与碱反应,所以符合题意。
答案:B
9.(2011四川)下列“化学与生活”的说法不正确的是
A.硫酸钡可用于钡餐透视 B.盐卤可用于制豆腐
C.明矾可用于水的消毒、杀菌 D.醋可用于除去暖水瓶中的水垢
解析:明矾溶于水可水解产生氢氧化铝胶体,能净化水,但不能消毒和杀菌。
答案:C
8. (2011重庆)“化学,让生活更美好”,下列叙述不能直接体现这一主旨的是
A. 风力发电,让能源更清洁 B.合成光纤,让通讯更快捷
C.合成药物,让人类更健康 D.环保涂料,让环境更宜居
解析:考查材料、环保、人体健康等有STS价值取向的有关内容。风力发电属于新能源,但属于物理变化,与化学无关,因此是不能直接体现这一主旨的,选项B、C、D均与化学有关,所以该题的正确答案是A。
答案:A
7.(2011天津高考)化学在人类生活中扮演着重要角色,以下应用正确的是
A.用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可到达水果保鲜的目的
B.为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂
C.使用无磷洗衣粉,可彻底解决水体富营养化问题
D.天然药物无任何毒副作用,可长期服用
解析:乙烯可以作为水果的催熟剂,要想使水果到达保鲜的目的,需要及时吸收水果释放出的乙烯,由于乙烯具有还原性,可以用高锰酸钾溶液来吸收,A正确;食品添加剂需要在一定范围内才允许使用,所以其用量要严格控制,B不正确;水中氮、磷过的是造成水体富营养化的主要原因,所以使用无磷洗衣粉,不可能彻底解决水体富营养化问题,C不正确;任何药物都有毒副作用,不难长期服用,D也不正确。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com