
8.在元素周期表中锡元素的某些信息如图所示,下列有关锡的说法正确的是
A.属于非金属元素 B.原子序数为50
C.相对原子质量是118.7g D.原子核内中子数为50
7. 下列物质中,属于纯净物的是
下列物质中,属于纯净物的是
A.粗盐 B.糖水  C.黄铜 D.氢气
C.黄铜 D.氢气
6.下列物质中,属于合成纤维的是
A.棉花 B.涤纶 C.羊毛 D.蚕丝
5.下列化肥中,属于钾肥的是
A.尿素 B.碳酸氢铵 C.硫酸钾 D.过磷酸钙
4.下列图示实验操作中,正确的是
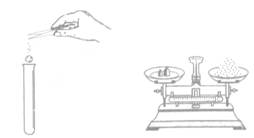
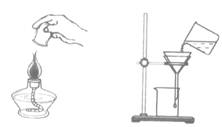
A.加入大理石 B.称量固体 C.熄火酒精灯 D.过滤
3.地壳中含量最多的元素是
A.铝 B.铁 C.硅 D.氧
2.NO中氮元素的化合价为
A.+2 B.+1 C.-2 D.—1
一、选择题
1.空气中含量最多的气体是
A.氮气 B.氧气 C.二氧化碳 D.水蒸气
14.(2011四川,14分)
开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。

请回答下列问题:
(1)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为______________。
(2)该循环工艺过程的总反应方程式为_____________。
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是____________。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
①电池放电时,负极的电极反应式为____________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为____________
解析:本题主要考察热化学方程式的书写、勒夏特列原理的应用和电极反应方程式的书写。
答案:(1)4FeS2(s)+11O2(g) 2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol
2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol
(2)2H2O+SO2=H2SO4+H2
(3)减小氢气的浓度,使HI分解平衡正向移动,提供HI的分解率
(4)MH+OH--e-=M+H2O
2H2O+O2+4e-=4OH-
13.(2011北京高考26,14分)
氯碱工业中电解饱和食盐水的原理示意图如下图所示:
(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
 (3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用
;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用
;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。
精致流程如下(淡盐水和溶液A来电解池):

①盐泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
④经过程Ⅲ处理,要求盐水中c 中剩余Na2SO3的含量小于5mg /L,若盐水b中NaClO的含量是7.45 mg /L ,则处理10m3 盐水b ,至多添加10% Na2SO3溶液 kg(溶液体积变化忽略不计)。
解析:(1)电解时在电极的作用下,溶液中的阳离子向阴极作定向运动,阴离子向阳极作定向运动,所以电解饱和食盐水时Na+和H+向阴极运动并放电,但H+比Na+易得电子,所以H+首先放电,方程式为2H++2e-=H2↑。由于H+是水电离出的,所以随着H+的不断放电,就破坏了阴极周围水的电离平衡,OH-的浓度就逐渐增大,因此溶液A的溶质是NaOH。由于Cl-比OH-易失电子,所以在阳极上CI-首先放电,方程式为2Cl--2e-=Cl2↑。因此电解饱和食盐水的离子方程式为2Cl-+2H2O 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。
(2)见解析(1)
(3)由于阳极上生成氯气,而氯气可溶于水,并发生下列反应Cl2+H2O HCl+HClO,根据平衡移动原理可知增大盐酸的浓度可使平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的溢出。
HCl+HClO,根据平衡移动原理可知增大盐酸的浓度可使平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的溢出。
(4)由于溶液中含有Mg2+,所以用溶液A(即NaOH)调节溶液的pH时,会产生Mg(OH)2沉淀,即盐泥a中还含有Mg(OH)2;淡盐水中含有氯气,氯气具有强氧化性,可将NH4+氧化为N2,而氯气被还原成Cl-,方程式为2NH4++3Cl2+8OH-=8H2O+6Cl-+N2↑;沉淀转化的实质就是沉淀溶解平衡的移动,一般说来,溶解度小的沉淀转化成溶解度更小的沉淀容易实现。由于BaSO4的溶解度比BaCO3的小,所以加入BaCO3后,溶液中的SO42-就结合Ba2+生成更难溶的BaSO4沉淀,同时溶液中还存在Ca2+而CaCO3也属于难溶性物质,因此还会生成CaCO3沉淀;NaClO具有强氧化性,可将Na2SO3氧化成Na2SO4,方程式为Na2SO3+NaClO=Na2SO4+NaCl。10m3 盐水b中含NaClO的物质的量为 ,由方程式可知消耗Na2SO3的质量为1mol×126g/mol=126g。若设需要10% Na2SO3溶液的质量为X,则有
,由方程式可知消耗Na2SO3的质量为1mol×126g/mol=126g。若设需要10% Na2SO3溶液的质量为X,则有 ,解得x=1760g,即至多添加10% Na2SO3溶液1.76kg。
,解得x=1760g,即至多添加10% Na2SO3溶液1.76kg。
答案:(1)NaOH
(2)2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(3)氯气与水反应:Cl2+H2O HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。
HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。
(4)①Mg(OH)2
②2NH4++3Cl2+8OH-=8H2O+6Cl-+N2↑
③SO42-、Ca2+
④1.76
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com