
2、(2013·广东理综·23)下列实验的现象与对应结论均正确的是
|
选项 |
操作 |
现象 |
结论 |
|
A |
将浓硫酸滴到蔗糖表面 |
固体变黑膨胀 |
浓硫酸有脱水性和强氧化性 |
|
B |
常温下将Al片放入浓硝酸中 |
无明显变化 |
Al与浓硝酸不反应 |
|
C |
将一小块Na放入无水乙醇中 |
产生气泡 |
Na能置换出醇羟基中的氢 |
|
D |
将水蒸气通过灼热的铁粉 |
粉末变红 |
铁与水在高温下发生反应 |
1.(2013·四川理综化学·1)化学与生活密切相关,下列说法不正确的是
A.二氧化硫可广泛用于食品的漂白
B.葡萄糖 可用于补钙药物的合成
可用于补钙药物的合成
C.聚乙烯塑料制品可用于食品的包装
D.次氯酸钠溶液可用于环境的消毒杀菌
[答案]A
解析:SO2可被人体吸收进入血液,对全身产生毒性作用,它能破坏酶的活力,影响人体新陈代谢,对肝脏造成一定的损害,慢性毒性试验显示,SO2有全身性毒作用,故不可用于食物漂白。A错。葡萄糖酸钙常被用做补钙剂,B正确;聚乙烯可做食品的包装,而聚氯乙烯不可,C正确;“84”消毒液的有效成分就是NaClO,可用于环境消毒,D正确。
12、(2013·广西理综 ·29)(15分)铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
·29)(15分)铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
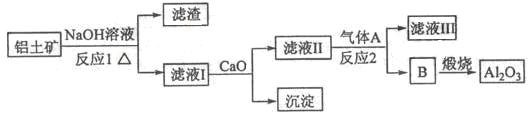
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
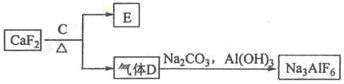
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
回答下列问题:
(1)写出反应1的化学方程式 ;
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为 ;
(3)E可作为建筑材料,化合物C是 ,写出由D制备冰晶石的化学方程式 ;
(4)电解制铝的化学方程式是 ,以石墨为电极,阳极产生的混合气体的成分是 。
[答案](1)2NaOH+SiO2=Na2SiO3+H2O(2分) 2NaOH+Al2O3=2NaAlO2+H2O(2分)
(2)CaSiO3(2分) 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(2分)
(3)浓H2SO4(1分) 12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O(2分)
(4)2Al2O3 4Al+3O2↑(2分) O2、CO2(CO)(2分)
4Al+3O2↑(2分) O2、CO2(CO)(2分)
[解析]本题是常考的经典Al的制备实验,但新意在有两个流程图进行比较分析。①从铝土矿中提炼Al2O3②以萤石(CaF2)和纯碱为原料制备冰晶石,把两种产物经电解制备氧化铝,命题很妙。
由流程①图可知反应1用于溶解二氧化硅和氧化铝,Fe不与碱反应,利用过滤除去Fe,所以滤液中的成分为硅酸钠和偏铝酸钠,加入氧化钙后硅酸钠转化为硅酸钙沉淀,偏铝酸钠溶液中通入二氧化碳气体后转变为氢氧化铝,加热后生成氧化铝。
由流程②图可知E可作为建筑材料,推知其为硫酸钙,C为硫酸,气体D为HF,其原理利用硫酸的高沸点制取低沸点的HF,再由HF与碳酸钠、氢氧化铝制备冰晶石,利用复分解反应的原子守恒不难写出反应方程式。
电解制备铝的过程中由于阳极生成了氧气,高温下碳会被氧气氧化为CO、CO2,因此阳极产生的混合气体为 O2、CO2(CO)。
11、(2013·广西理综·27)(15分)五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 ;
(4)D最高价氧化物的水化物的化学式为 ;
(5)单质D在充足的单质E中燃烧,反应的化学方程式为 ;D在不充足的E中燃烧,生成的主要产物的化学式为 ;
(6)单质E与水反应的离子方程式为 。
[答案](1)Na(1分) Cl (1分) (2)PH3(2分)
(3)NH4Cl(2分) 离子键和共价键(2分)
(4)H3PO4(2分)
(5)2P+5Cl2 2PCl5(2分) PCl3(1分)
2PCl5(2分) PCl3(1分)
(6)Cl2+H2O=H++Cl-+HClO(2分)
[解析]由题干信息,找准关键点:(1)A、B、C、D、E的原子序 数依次增大;(2)A和C同族,B和D 同族,C离子和B离子具有相同的电子层结
数依次增大;(2)A和C同族,B和D 同族,C离子和B离子具有相同的电子层结 构。(3)A和B、D、E均能形成共价型化合物;(4)A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。可推断出A、B、C、D、E分别为H、N、Na、P、Cl五种元素。
构。(3)A和B、D、E均能形成共价型化合物;(4)A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。可推断出A、B、C、D、E分别为H、N、Na、P、Cl五种元素。
(1) 五种元素中,原子半径最大的是Na,非金属性最强的是Cl。
(2) 形成的共价化合物为NH3、PH3、HCl,由于P的非金属性最差,所以PH3的稳定性最差。
(3) 氯化铵中既含有离子键,也含有共价键。
(4) D最高价氧化物的水化物为磷酸,注意与硝酸化学式的区别。
(5) 氯气足量时为PCl5,氯气不足时为PCl3。
(6) 注意次氯酸为弱酸,不能拆分。
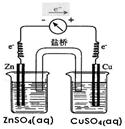
33、解析:(1)Cl2是有刺激性气味、密度比空气大、有毒的黄绿色气体,在制备和收集Cl2时必须有尾气吸收装置。A没有排气管不能用于收集气体;B用于收集密度比空气小的气体;C用以收集密度比空气大的气体,且有尾气吸收装置;D吸收氯气不能收集。氯气与水反应生成盐酸和次氯酸,次氯酸为弱酸部分电离,所以有氧化性的含氯粒子是Cl2、HClO和ClO—。比较Cl2和Br2的氧化性,可以利用置换反应。所以其具体操作是:取少量新制氯水和CCl4于试管中,用胶头滴管向试管中滴加NaBr溶液,振荡静置,溶液下层呈橙色。(2)由题给试剂, 结合原电池的形成条件可知可以组合的原电池可以是:锌铜、锌铁、铁铜原电池。由图示所给电子移动方向可知左边为负极(活泼金属)、右边为正极(不活泼金属)
结合原电池的形成条件可知可以组合的原电池可以是:锌铜、锌铁、铁铜原电池。由图示所给电子移动方向可知左边为负极(活泼金属)、右边为正极(不活泼金属) ,则组装的原电池可以如下:
,则组装的原电池可以如下:
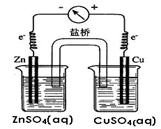
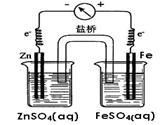
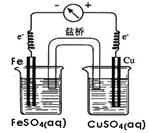
由所给的电极材料可知,当铜片做电极时,铜片一定是正极,则负极是活泼的金属(失电子发生氧化反应),反应的现象是电极逐渐溶解。以Zn和Cu做电极为例,如果不用盐桥则Zn与CuSO4反应,置换出的Cu附着在Zn表面,阻碍了Zn与CuSO4的接触,不能提供稳定电流。(3)根据牺牲阳极的阴极保护法,可知被保护的金属作阴极,即Zn作为阳极。
答案:(1)C;Cl2、HClO和ClO—;取少量新制氯水和CCl4于试管中,用胶头滴管向试管中滴加NaBr溶液,振荡静置,溶液下层呈橙色(2)(装置图如下);电极逐渐溶解;甲;可以避免活泼金属如Zn和CuSO4的接触,从而提供稳定电流(3)Zn

命题意图:化学实验、元素化合物与化学反应原理
10.(2013·广东理综·33)(17分)
化学实验 有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)
在实验室中用 浓盐酸与MnO2共热制取Cl2并进行相关实验。
浓盐酸与MnO2共热制取Cl2并进行相关实验。
① 列收集Cl2的正确装置时 。
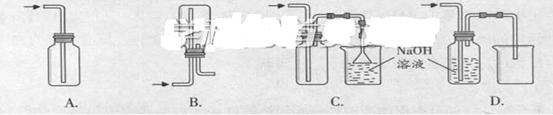
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中, 。
(2) 能量之间可以相互转化:点解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
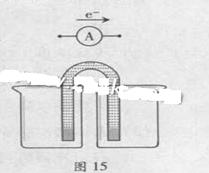 限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
① 完成原电池的装置示意图(见图15),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
② 铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
③ 甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在( 2)的材料中应选 作阳极。
2)的材料中应选 作阳极。

9.(2013·四川理综化学·8)(11分)
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。Y、Z分别与钠元素可以形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。
请回答下列问题:
 ⑴M固体的晶体类型是
。
⑴M固体的晶体类型是
。
⑵Y基态原子的核外电子排布式是 ① ;G分子中X原子的杂化轨道的类型是 ② 。
⑶L的悬浊液加入Q的溶液,白色沉淀转化为黑色沉淀,其原因是 。
⑷R的一种含氧酸根RO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
[答案]
(1)M的晶体类型,M为NH4Cl,属离子晶体;
(2)Y基态原子的电子排布:1s2 2s2 2p6 3s2 3p4,G分子中X原子的杂化轨道类型为sp3杂化;
(3)AgCl悬浊液中加入Ag2S,Ksp(AgCl)<Ksp(Ag2S),则溶液中的AgCl转化为Ag2S,由白色沉淀变为黑色沉淀;
(4)R的含氧酸跟RO42-为FeO42-,向其钠盐溶液中加入硫酸,溶液变黄,说明生成Fe3+,并有无色气体生成,反应中Fe的化合价降低,只能是O元素的化合价升高,则无色气体比为O2,反应的离子方程式为:4FeO42-+2 0
0 H+==4Fe3++3O2↑+10H2O
H+==4Fe3++3O2↑+10H2O
解析:①气体G可溶于水且水溶液呈碱性,知气体G为NH3,气体G由X的单质与H2化合得到,则X为N元素。
②Y的单质为黄色晶体,知Y为S元素。
③R的3d轨道电子数为为4s轨道的三倍,则R为第四周期元素,4s轨道电子数为2,3d轨道为6,R原子的电子排布为1s2 2s2 2p6 3s2 3p6 3d6 4s2,则R为Fe元素。
④Z的原子序数大于Y,且能与Na化合,则X为Cl元素。
⑤则Q为Na2S,J为NaCl,I为AgCl,M为NH4Cl
30.为了除去工业Br2中微量的Cl2,可向工业Br2中
a.通入HBr b.加入Na2CO3溶液  c.加入NaBr溶液 d.加入Na2SO3溶液
c.加入NaBr溶液 d.加入Na2SO3溶液
[答案]27.通风橱,污染环境。28.Br2易挥29.3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O.
用盐酸酸化,则盐酸被NaBrO3氧化,原因是Br2易挥发,对大气有污染。30.c.
[解析]Cl2、Br2 都是污染气体,应该在通风橱进行操作;步骤③所发生反应是归中反应,盐酸有还原性,NaBrO3氧化性,二者可发生氧化还原反应;利用NaBr溶液与Cl2反应,然后分液可除去Cl2。
[考点定位]本题考查工业制Br2,考查分析问题解决问题的能力。
29.写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是 。步骤②的产品有时运输到目的地后再酸化,主要是因为
28.Br2可用热空气吹出,其原因是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com