
2. (2013·新课标卷Ⅱ·8)下列叙述中,错误的是
A.苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯
B.苯乙烯在合适条件下催化加氢可生成乙基环己烷
C.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D.甲苯与氯气在光照下反应主要生成2,4-二氯甲笨
解析:考察有机反应原理。甲苯与氯气在光照下反应主要是甲基上的H被取代。选择D
1.(2013·北京理综·12)用右图所示装置检验乙烯时不需要除杂的是
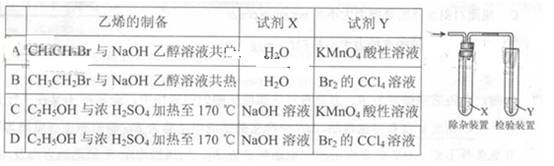
[答案]B
[解析]A、B选项乙烯中的杂质为乙醇,乙醇可使KMnO4褪色,故必须用水除去。乙醇不能使Br2的CCl4溶液褪色,故不需出去。C、D选项乙烯中杂质为乙醇、SO2和CO2。其中乙醇、SO2均可使KMnO4褪色,故用氢氧化钠溶液除去;尽管乙醇不能使Br2的CCl4溶液褪色,但SO2在有H2O(g)存在的情况下能使Br2的CCl4溶液褪色,故用 氢氧化钠溶液除去。故ACD错误,B
氢氧化钠溶液除去。故ACD错误,B 正确。
正确。
13.(2013·江苏化学·16)(12分)氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
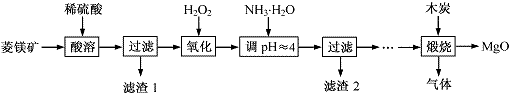
(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2的成分是 (填化学式)。
 (
( 4)煅烧过程存在以下反应:
4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用右图装置对煅烧产生的气体进行分步吸收或收集。
①D中收集的气体可以是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
12、(2013·四川理综化学·11)(15分)
明矾石经处理后得到明矾[ KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
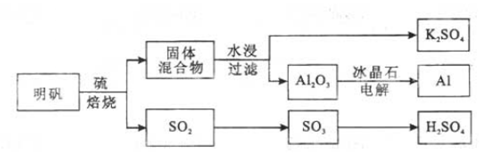
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2+48H2O
 请回答下列问题:
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是 。
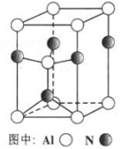
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g)
+O2(g) 2SO3(g)
△H1= 一197 kJ/mol;
2SO3(g)
△H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3 (g)与H2O(l)反应的热化学方程式是 ① 。
焙烧948t明矾(M=474 g/mol ),若SO2 的利用率为96%,可生产质量分数为98%的硫酸 ② t。
[答案](1)S
(2)蒸发结晶
(3)4
(4)Al+3NiO(OH)+H2O==NaAlO2+3Ni(OH)2
(5)SO3(g)+H2O(l)==H2SO4(l), ΔH=-130 KJ/mol
432t
解析:(5):ΔH=(ΔH3-ΔH1-2ΔH2)/2=-130 KJ/mol
948 t明矾生成SO2物质的量为4500mol
故生成硫酸的质量m=4500×0.96×98÷0.98=432000Kg=432t.
11.(2013·北京理综·28)(15分)
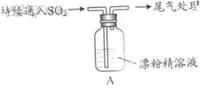
某学生对SO2与漂粉精的反应进行实验探究:
|
操作 |
现象 |
|
取4g漂粉精固体,加入100mL水 |
部分固体溶解,溶液略有颜色 |
|
过滤,测漂粉精溶液的pH |
pH试纸先变蓝(约为12),后褪色 |
 |
i.
液面上方出现白雾; ii. 稍后,出现浑浊,溶液变为黄绿色; iii. 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程是 。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验 白雾,无变化;
白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是 。
②由实验a、b不能判断白雾中含有HC1,理由是 。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 。
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
[答案]
(1)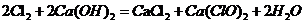 ;
;
(2)碱性、漂白性;
(3)①、检验白雾中是否Cl2,排除Cl2干扰;
②、白雾中含有SO2,SO2可以使酸化的AgNO3溶液产生白色沉淀;
(4)向漂白精溶液中逐滴滴 入硫酸,观察溶液颜色是否变为黄绿色;
入硫酸,观察溶液颜色是否变为黄绿色;
(5)①、CaSO4;
②、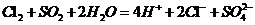 。
。
[解析]
(1)Cl2和Ca(OH)2生成氯化钙、次氯酸钙与水;
(2)pH试纸先变蓝(约为12),说明溶液呈碱性,后颜色褪去,说明具有漂白性;
(3)①反应中生成Cl2,用湿润的碘化钾淀粉试纸检验白雾中是否Cl2,排除Cl2干扰;
②白雾中含有SO2,可以被硝酸氧化为硫酸,故SO2可以使酸化的AgNO3溶液产生白色沉淀;
(4)向漂白精溶液中逐滴滴入硫酸,观察溶液颜色是 否变为黄绿色;
否变为黄绿色;
(5)①取上层清液,加入BaC12溶液,产生白色沉淀,说明SO2被氧化为SO42-,故沉淀X为CaSO4;
②溶液呈黄绿色,有Cl2生成,Cl2与SO2反应生成盐酸与硫酸。
10.(2013·福建理综·23)(16分)
利用化石燃料开采、加工过程产生的H2S废气制取氢气,既廉价又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质量数之和为27,则R的原子结构示意图为_________
②常温下,不能与M单质发生反应的是_________(填序号)
 a.CuSO4溶液 b.Fe2O3
c.浓硫酸
a.CuSO4溶液 b.Fe2O3
c.浓硫酸
d.NaOH e.Na2CO3固体
(2)利用H2S废气制取氢气来的方法有多种
①高温热分解法
已知:H2S(g)==H2+1/2S2(g)
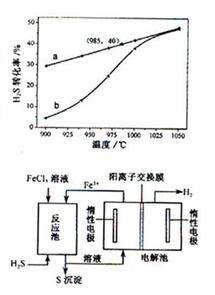
在恒温密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见右图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985℃时H2S按上述反应分解的平衡常数K=________;说明温度的升高,曲线b向曲线a逼近的 原因:___________
原因:___________
②电化学法
该法制氢过程的示意图如右。反应池中反应物的 流向采用气、液逆流方式,其目的是___________;反应池中发生反应的化学方程式为_____________________。反应后的溶液进入电解池,电解总反应
流向采用气、液逆流方式,其目的是___________;反应池中发生反应的化学方程式为_____________________。反应后的溶液进入电解池,电解总反应 的离子方程式为_______________________。
的离子方程式为_______________________。
[知识点]物质结构和元素周期律,元素化合物性质,化学平衡常数以及电化学反应等知识。
[答案]
(1)①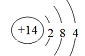 ②b、e
②b、e
(2)①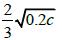 温度升高,反应速率加快,达到平衡所需的时间缩短(或其他合理条件)
温度升高,反应速率加快,达到平衡所需的时间缩短(或其他合理条件)
②增大反应物接触面积,使反应更充分
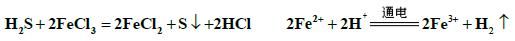
[解析](1)①根据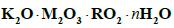 可知M、R 的化合价分别是+3、+4 价,
可知M、R 的化合价分别是+3、+4 价,
再结合二者的质子数之和为27,可推知X是Al、Y是Si,则Si 的原子结构示意图为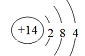 。
。
②Al 和Fe2O3 发生铝热反应的条件是高温,也不和Na2CO3 固体反应;(2)根据图像可知,985℃ 时,H2S的平衡转化率为40%,我们根据三段式计算出化学平衡常数:

由图可知,当温度升高时,达到平衡的时间缩短了,也就是说升高温度加快了化学反应速率;②采用气、液逆流的方式进行,其目的是增大了气、液的接触面积,增大了化学反应速率,使反应更容易进行。根据反应池的结构,可知:参加反应的物质是H2S和2FeCl3 ,生成物是S 单质,说此反应为氧化还原反应,所以生成的物质还有FeCl2,即方程式为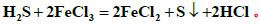 从反应池流出的溶液中含有Fe2+ ,经过电解池也变回了Fe3+ ,同时还有H2 生成,故电解反应方程式为
从反应池流出的溶液中含有Fe2+ ,经过电解池也变回了Fe3+ ,同时还有H2 生成,故电解反应方程式为
9、(2013·天津化学·10)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
|
离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
|
浓度/mol.L |
4x10-6 |
6x10-6 |
2x10-5 |
4x10-5 |
3x10-5 |
2x10-5 |
根据表中数据判断PM2.5的酸碱性为——,试样的PH值=————
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g)
 H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)  H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式——————————————————;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是————
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:
N2(g)+O2(g)  2NO(g)
2NO(g)  H>0
H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8x10-4mol.计算该温度下的平衡常数K= ___________
汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是————
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的 H>0,简述该设想能否实现的依据—————
H>0,简述该设想能否实现的依据—————
③目前,在汽车尾气系统中装置催化转化器可减少 CO和NO的污染,其 化学反应方程式为———————————
化学反应方程式为———————————
[解析]该题综合考察化学反应原理的基础知 识。涉及离子的水解、PH值的计算、盖斯定律的应用、化学平衡常数的计算、自由能的应用等。
识。涉及离子的水解、PH值的计算、盖斯定律的应用、化学平衡常数的计算、自由能的应用等。
(1) 观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性。试样的PH值根据溶液中电荷守恒计算H+离子浓度为10-4,PH值为4.
(2)
焦炭与水蒸汽反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)  H=+131.3kJ/mol
H=+131.3kJ/mol
洗涤含SO2的烟气,根据酸性氧化物的性质选a.Ca(OH)2 b.Na2CO3。
(3) 计算平衡常数时,先计算物质的平衡量N2为0.8-4x10-4, O2为0.2-4x10-4,NO为8x10-4,带入平衡常数表达式即可,得4x10-6.
气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应。根据 G=
G= H-T
H-T S,
S,  G>0,不能实现。汽车尾气系统中装置反应的化学方程式
G>0,不能实现。汽车尾气系统中装置反应的化学方程式
43、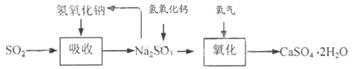
[解析]用硫酸和亚硫酸纳反应制取二氧化硫利用固液不加热制取气体装置,因此,选ae
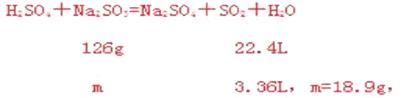
设含40%的亚硫酸钠的样品质量为100g,则生成硫酸钠的质量为45.1g,则这时亚硫酸钠的质量分数为(100-40)/100-40+45.1=57.1%,则至少需称取该亚硫酸钠18.9/57.1%=33.1g。由于石灰的碱性比氢氧化钠弱,吸收SO2的速率慢、效率低,但吸收成本比氢氧化钠低的多。
[考点定位]本题以二氧化硫烟气处理为情景考查装置选择、计算、成本核算、方案设计及分析问题解决问题的能力。
42.酸性氧化与碱的反应。结果便宜,成本低;吸收慢,效率低。
43.在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
[答案]40.ae 41.18.9 ,33.1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com