
3.(2013·上海化学·2)氰酸铵(NH4OCN)与尿素[CO(NH2)2]
A.都是共价化合物 B.都是离子化合物
C.互为同分异构体 D.互为同素异形体
[答案]C
[解析]氰酸铵是离子化合物,尿素是共价化合物,他们的分子式相同,结构不同,是同分异构体的关系,因此选C
2.(2013·上海化学·4)下列变化需克服相同类型作用力的是
A.碘和干冰的升华 B.硅和C60的熔化
C.氯化氢和氯化钾的溶解 D.溴和汞的气化
[答案]A
[解析]A项变化客服的都是分子间力,正确,硅和C50的融化分别克服的都是共价键,分子间力, B项错误,氯化氢和氯化钾的溶解分别克服的都是共价键,离子键,C项错误,溴和汞的气化分别克服的都是分子间力金属键,D项错误,
1.(2013·上海化学·3)230Th和232Th是钍的两种同位素,232Th可以转化成233U。下列有关Th的说法正确的是
A. Th 元素的质量数是232 B. Th 元素的相对原子质量是231
C. 232Th 转换成233U是化学变化 D. 230Th和232Th的化学性质相同
[答案]D
[解析]232Th 230Th的质量分别是232,230 A项错误,元素的相对原子质量是由各种同位素的相对原子质量取得的平均值,B项错误同位素的物理性质可以不同,但化学性质几乎相同,D项正确,化学变化是生成新物质的变化,原子不变,而C项的原子发生变化错误。
9.(2013·江苏化学·20)(14分)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)=6CaO(s )+P4(s)+10CO(g) △H1=+3359.26 kJ·mol-1[来源:]
)+P4(s)+10CO(g) △H1=+3359.26 kJ·mol-1[来源:]
CaO(s)+SiO2(s)=CaSiO3(s) △H2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) △H3
则△H3= kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2S O4
O4
 60molCuSO4能氧化白磷的物质的量是
60molCuSO4能氧化白磷的物质的量是
。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如右图所示。
①为获得尽可能纯的NaH2PO4,pH应控制在
;pH=8时,溶液中主要含磷物种浓度大小关系为  。
。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是
(用离子方程式表示)。
(4)磷的化合物三氯氧磷(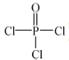 )与季戊四醇(
)与季戊四醇(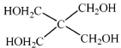 )以物质的量之比2:1 反应时,可
)以物质的量之比2:1 反应时,可 获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。
获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。
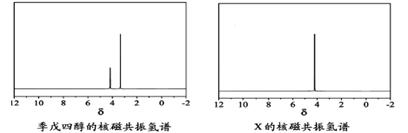
①酸性气体是 (填化学式)。
②X的结构简式为 。
8.(15分)(2013·新课标卷I·28)
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由 合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
①CO(g)+ 2H2(g) = CH3OH(g) △H1=-90.1 kJ·mol-1
②CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1
水煤气变换反应:
③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=-41.1 kJ·mol-1
二甲醚合成反应:
④2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=-24.5 kJ·mol-1
⑴Al2O3是合 成气直接制备
成气直接制备 二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是
(以化学方程式表示)
二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是
(以化学方程式表示)
⑵分析二甲醚合成反应④对于CO转化率的影响 。
⑶由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。
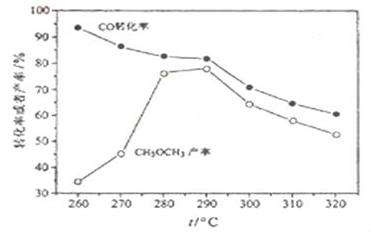
⑷有研究者在催化剂(含Cu-Zn-Al-O和Al2O3),压强为5.0MPa的条件下由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是____________。
⑸二甲醚直接燃料电池具有启动快,效率高等优点,其能量密度高于甲醇直接燃烧燃料电池(5.93kW·h·kg-1),若电解质为酸性,二甲醚直接燃料电池的负极反应为_______________。
一个二甲醚分子经过电化学氧化,可以产生___________个电子的电量;该电池理论输出电压1.20V,能量密度E=_____(列式计算,能量密度=电池输出电能/燃料质量,1kW·h=3.6×105J )
[答案](1)Al2O3(铝土矿)+2NaOH=2NaAlO2+H2O;NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓;

(2)消耗甲醇,促进甲醇合成反应①平衡向右移,CO转化率增大,生成的H2O通过水煤气反应消耗部分CO
(3)2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g);ΔH=-204.7kJ/mol;该反应分子数减小,压强升高平衡右移,CO和H2的转化率增大,CH3OCH3产率增加,压强升高使CO和H2的浓度增加,反应速率增大。



7.(2013·福建理综·11)某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
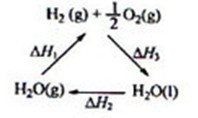

下列说法不正确的是
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.右图中△H1=△H2+△H3
D.以CO和O2构成的碱性燃料电池的负极反应式为 CO+4OH——2e—=CO32—+2H2O
[知识点]盖斯定律,化学反应中的能量变化,电极反应式的书写
[答案]C
[解析]A 项,我们把两个反应相叠加就可以得到,所以CeO2 没有消耗;B 项,该反应实现了太阳能向化学能的转化;C 项,根据所给的关系可知△H3=-(△H2+△H1);D 项,碱性燃料电池的总反应为2CO+4OH—+O2—=2CO32—+2H2O, 负极反应是CO+4OH——2e—=CO32—+2H2O, 正极反应是O2+2H2O—4e—=4OH—。
6.(2013·海南化学·5)已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A .12△H3+5△H2-2△H1 B.2△H1-5△H2-12△H3
.12△H3+5△H2-2△H1 B.2△H1-5△H2-12△H3
C.12△H3-5△H2 -2△ H1 D.△H1-5
H1 D.△H1-5 △H2-12△H3
△H2-12△H3
[答案]A
[解析]:盖斯定律常规考查。
5.(2013·重庆理综·12)已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g) ΔH= bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1
下列叙述正确的是( )
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH
C.Cl-Cl键的键能kJ·mol-1
D.P-P键的键能为kJ·mol-1
解析:考察盖斯定律以及键能与反应热的关系。根据P4是正四面体,P4有6个P—P键,
6E(P—P)+6(Cl—Cl)—12×1.2c=a, 6E(P—P)+10(Cl—Cl)—20c=b, Cl2(g)+PCl3(g)=PCl5(g) △H=( bkJ·mol-1—akJ·mol-1)/4。A项,E(P—P)<E(P—Cl);B项,PCl5是固态,无法计算;C项,4E(Cl—Cl)+12×1.2c—20×c=b—a,有E(Cl—Cl)= ,正确;D项,经过计算,E(P—P)= ,错误。选择C。
4.(2013·新课标卷Ⅱ·12)在1200℃时,天然气脱硫 工艺中会发生下列反应
工艺中会发生下列反应
H2S(g)+ 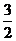 O2(g)=SO2(g)+H2O(g)
△H1
O2(g)=SO2(g)+H2O(g)
△H1
2H2S(g)+SO2(g)=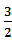 S2(g)+2H2O(g) △H2[来源:]
S2(g)+2H2O(g) △H2[来源:]
H2S(g)+ O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3
2S(g) =S2(g) △H4
则△H4的正确表达式为
A.△H4=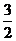 (△H1+△H2-3△H3) B.△H4=
(△H1+△H2-3△H3) B.△H4=
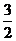 (3△H3-△H1-△H2)
(3△H3-△H1-△H2)
C.△H4=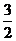 (△H1+△H2+3△H3)
D.△H4=
(△H1+△H2+3△H3)
D.△H4= 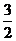 (△H1-△H2-3△H3)
(△H1-△H2-3△H3)
解析:考察盖斯定律。根据S守恒原理,要得到方程式4,可以用(方程式1+方程式2—3×方程式2)×;所以,选择A。
3.(2013·北京理综·6)下列设备工作时,将化学能转化为热能的是

[答案]D
[解析]
A、硅太阳能电池是将太阳能直接转化为电能,故错误;B、锂离子电池将化学能直接转化为电能,故错误;C、太阳能集热器是将太阳能转变为热能,故错误;D、燃料燃烧将化学能直接转化为热能,故正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com