
37.试剂b是 ,步骤Ⅳ的目的是 。
36.已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 ,控制溶液的pH约为8.0的目的是 、 。
35.上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的氢溴酸500ml,所需的玻璃仪器有玻璃棒、 。
5.(2013·上海化学·35-39)溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
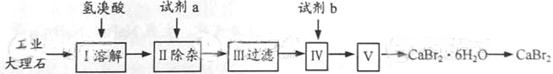
完成下列填空:
30.为了除去工业Br2中微量的Cl2,可向工业Br2中
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
[答案]27.通风橱,污染环境。28.Br2易挥29.3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O.
用盐酸酸化,则盐酸被NaBrO3氧化,原因是Br2易挥发,对大气有污染。30.c.
[解析]Cl2、Br2 都是污染气体,应该在通风橱进行操作;步骤③所发生反应是归中反应,盐酸有还原性,NaBrO3氧化性,二者可发生氧化还原反应;利用NaBr溶液与Cl2反应,然后分液可除去Cl2。
[考点定位]本题考查工业制Br2,考查分析问题解决问题的能力。
29.写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是 。步骤②的产品有时运输到目的地后再酸化,主要是因为
28.Br2可用热空气吹出,其原因是
27.Cl2氧化Br-应在 条件下进行,目的是为了避免
4.(2013·上海化学·27-30)溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
3.(2013·安徽理综·7)我国科学家研制出一中催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2 催化剂 CO2+H2O。下列有关说法正确的是
 A.该反应为吸热反应
B.CO2分子中的化学键为非极性键
A.该反应为吸热反应
B.CO2分子中的化学键为非极性键
C.HCHO分子中既含α键又含π键 D.每生成1.8gH2O消耗2.24L O2
[答案]C
[解析]A、该反应在室温下可以进行,故该反应为放热反应,错误;B、二氧化碳结构为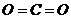 ,为极性键,错误;C、甲醛中,含有碳氧双键,故期中既含有
,为极性键,错误;C、甲醛中,含有碳氧双键,故期中既含有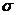 键又含有
键又含有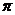 键,正确;D、氧气的体积,并没有标明状况,故不一定为2.24L,错误。
键,正确;D、氧气的体积,并没有标明状况,故不一定为2.24L,错误。
[考点定位]以除甲醛气体为新的情境,考查了化学反应基本理论和基本概念,涉及化学反应中能量变化,分子结构、化学键以及气体的体积等相关知识。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com