
6.(2013·广东理综·8)水溶解中能大量共存的一组离子是
A.Na+、Al3+、Cl-、CO32- B.H+、Na+、Fe2+、MnO4-
C.K+、Ca2+、Cl-、NO3- D. K+、NH4+、OH-、SO42-
5.(2013·安徽理综·9)下列分子或离子在指定的分散系中能大量共存的一组是
A.银氨溶液: Na+、K+、NO3-、NH3·H2O
B.空气: C2H2、CO2、SO2、NO
C.氢氧化铁胶体 : H+、K+、S2-、Br-
: H+、K+、S2-、Br-
D.高锰酸钾溶液: H+、Na+、SO42-、葡萄糖分子
[答案]A
[解析]A、可以共存;B、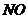 易被空气中氧气氧化生成
易被空气中氧气氧化生成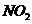 ,不能共存;C、氢氧化铁的胶体在酸性条件下不能共存;D、高锰酸根在酸性条件下具有强氧化性,葡萄糖具有还原性,能发生氧化还原反应不能大量共存。
,不能共存;C、氢氧化铁的胶体在酸性条件下不能共存;D、高锰酸根在酸性条件下具有强氧化性,葡萄糖具有还原性,能发生氧化还原反应不能大量共存。
[考点定位]考查粒子共存问题,涉及胶体的性质、物质的性质、氧化还原反应等。
4.(2013·四川理综化学·3)下列离子方程式正确的是
A.Cl2通入水中:Cl2+H2O = 2H++Cl-+ClO-
B.双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
C.用铜做电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
[答案]B
解析:A HClO 是弱电解质不拆,C .Cu做电解池电极时参加反应失电子做阳极。
.Cu做电解池电极时参加反应失电子做阳极。
3. (2013·新课标卷Ⅱ·10)能正确表示下列反应的离子方程式是
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
解析:考察离子方程式正误判断。A项,浓盐酸与铁屑反应生成Fe2+;B项,钠与CuSO4溶液反应,Na先与水反应,生成的NaOH再与硫酸铜反应;C项,是HCO3-与H+ 反应;选择D。
反应;选择D。
2.(2013·北京理综·8)下列解释事实的方程式不准确的是
A.用浓盐酸检验氨:NH3+HCl=NH4Cl
B.碳酸钠溶液显碱性:CO32-+H2O HCO-3+OH-
HCO-3+OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D.长期 盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O
盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O
[答案]C
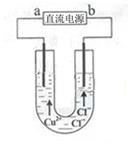 [解析]A、盐酸具有挥发性,挥发出的HCl与氨气反应生成氯化铵,冒白烟,故正确;B、碳酸钠是强碱弱酸盐,溶液中存在CO32-水解平衡:CO32-+H2O
[解析]A、盐酸具有挥发性,挥发出的HCl与氨气反应生成氯化铵,冒白烟,故正确;B、碳酸钠是强碱弱酸盐,溶液中存在CO32-水解平衡:CO32-+H2O HCO3-+OH-,使溶液呈碱性,故正确;C、钢铁发生吸氧腐蚀,铁作负极被氧化,电极
HCO3-+OH-,使溶液呈碱性,故正确;C、钢铁发生吸氧腐蚀,铁作负极被氧化,电极 反应式为Fe-2e-=Fe2+,故错误;D、石灰水与空气中的二氧化碳反应生成碳酸钙,故正确。
反应式为Fe-2e-=Fe2+,故错误;D、石灰水与空气中的二氧化碳反应生成碳酸钙,故正确。
1.(2013·上海化学·17)某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色衬垫;顾虑,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在5种离子
B.Cl-一定存在,且c(Cl‑)≥0.4mol/L
C.SO42-、NH4+、一定存在,Cl-可能不存在
D.CO32-、Al3+一定不存在,K+可能存在
[答案]B
[解析]根据加入过量NaOH溶液,加热,得到0.02mol气体,说明有NH4+,而且为0.02mol,同时产生红褐色沉淀,说明有Fe3+,而且为0.02mol,则没有CO32-,根据不溶于盐酸的4.66g沉淀,说明有SO42-,且为0.02mol,则根据电荷守恒可知一定有Cl-,至少有0.06mol,B正确。
[考点定位]本题考查离子共存及计算。
6.(14分)(2013·新课标卷Ⅱ·27)
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:
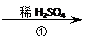
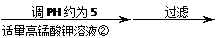
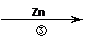
工业ZnO 浸出液 滤液

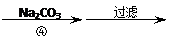
滤液 滤饼 ZnO
提示:在本实脸条件下,Ni(Ⅱ)不能被氧化:高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是 ,发生反应的离子方程式为
;
加高锰酸钾溶液前,若pH较低,对除杂的影响是 ;
(2)反应③的反应类型为 .过滤得到的滤渣中,除了过量的锌外还有 ;
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是
。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2 .取干操后的滤饼11.2g,煅烧后可得到产品8.1 g. 则x等于 。
解析:以工艺流程为形式考察化学知识,涉及反应原理、除杂方法、影响因素、反应类型、产物分析、洗涤干净的检验方法、化学计算等。
(1)除去的杂质离子是Fe2+和Mn2+;Fe2+以Fe(OH)3的形式沉淀下来,Mn2+以MnO2的形式沉淀下来;反应离子方程式为:
MnO4-+3Fe2++7H2O===MnO2↓+3Fe(OH)3↓+5H+;
3Mn2++2MnO4-+2H2O===5MnO2↓+4H+;
在加高锰酸钾溶液前,若pH较低,不会形成Fe(OH)3和MnO2沉淀。
(2)Zn+Ni2+===Zn2++Ni是置换反应;还有Ni。
(3)洗涤主要是除去SO42-和CO32-离子。检验洗净应该检验SO42-离子。取最后一次洗涤液少量,滴入稀盐酸,加入氯化钡溶液,没有白色沉淀生成,证明洗涤干净。
(4)令ZnCO3为amol,Zn(OH)2为bmol
125a+99b=11.2; 81(a+b)=8.1 解之,a:b=1:x=1:1,x=1
37.氢溴酸,除去过量的氢氧化钙。38.蒸发浓缩,冷却结晶。39.洗涤;23.50%.洗涤时,有少量的碳酸钙溶解。
[解析]35.用浓溶液配制500ml稀溶液,因此,需要量筒取经过计算需要的浓溶液的体积,然后溶解、配制500ml溶液,则需要胶头滴管、500ml容量瓶。36.加入的试剂a、控制溶液的pH约为8.0的目的是除去杂质Al3+、Fe3+,因此,a是氢溴酸。38.步骤V的结果得到CaBr2·6H2O,因此,其操作步骤为蒸发浓缩,冷却结晶。39.④对滤渣洗涤,除去表面吸附的离子,根据CaBr2~CaCO3可求CaBr2的质量0.94g,质量分数为23.50%。
[考点定位]本题以工艺流程的形式考查化学实验基本操作、计算、操作目的、误差分析。
39.制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ ;⑤称量。若得到1.88g碳酸钙,则溴化钙的质量分数为 (保留两位小数)。
若实验操作规范而测定结果偏低,其原因是 。
[答案]35.量筒、胶头滴管、烧杯、500ml容量瓶。36.石灰水,沉淀Al3+、Fe3+
38.步骤Ⅴ所含的操作依次是 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com