
7.(2013·江苏化学·14)一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=-lgc(M),
pc(CO32-)=-lgc(CO32-)。下列说法正确的是
A.MgCO3、CaCO3、MnCO3 的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32-)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-)
D.c点可表示MgCO3 的不饱和溶液,且c(Mg2+)<c(CO32-)
6.(2013·广东理综·12)50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)=4.0molL-1
B.饱和小苏打溶液中:c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D. pH=12的纯碱溶液中:c(OH-)=1.0×10-2molL-1
解析:50℃时,水的离子积常数大于1×10—14。pH=4的醋酸中,c(H+)=1×10—4 mol/L,A错误;饱和小苏打溶液中,HCO3—会发生水解反应导致浓度减小,c(Na+)>c(HCO3—),B错误;饱和食盐水中,c(Na+)+c(H+)=c(OH—)+c(Cl—)符合电荷守恒的关系,C正确;pH=12的碳酸钠溶液中, c(OH—)=KW/1×10—12>1×10—2 mol/L,D错误。答案:C
命题意图:水溶液中的离子平衡
5.(2013·安徽理综·13)已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3- + H2O  H2SO3 + OH- ①
H2SO3 + OH- ①
HSO3-
 H+ + SO32-
②
H+ + SO32-
②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A. 加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大
B. 加入少量Na2SO3固体,则c(H+)
+ c(Na+) = c(HSO3-) + c(OH-) +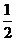 c(SO32-)
c(SO32-)
C. 加入少量NaOH溶液,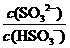 、
、 的值均增大
的值均增大
D. 加入氨水至中性,则2c(Na+) = c(SO32-)>c(H+) = c(OH-)
[答案]C
[解析]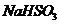 溶液显酸性,说明电离大于水解。A加入
溶液显酸性,说明电离大于水解。A加入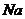 ,与水反应生成
,与水反应生成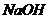 ,与
,与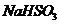 反应,故
反应,故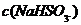 减小,错误;B该溶液中存在电荷守恒,故亚硫酸根前乘以2;错误;C、加入少量
减小,错误;B该溶液中存在电荷守恒,故亚硫酸根前乘以2;错误;C、加入少量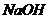 ,
,
[考点定位]考查电解质溶液,涉及弱电解质的电离和盐类的水解、三大守恒关系的应用。
4、(2013·天津化学·5)下列有关电解质溶液的说法正确的是
A、在蒸馏水中滴加浓H2SO4,KW不变
B、CaCO3难溶于稀硫酸,也难溶于醋酸
C、在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
D、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
[解析]该题考查电解质溶液的基本知识。A选项在蒸馏水中滴加浓H2SO4,放出热量,溶液温度升高,KW变大,错误。B选项CaCO3难溶于稀硫酸,但能难溶于醋酸,错误。C选项时溶液中的质子守恒,正确。D选项CH3COONH4双水解,促进水的电离,水的电离程度增大,错误。
答案:C
3、(2013·天津化学·4)下列实验误差分析错误的是
A、用湿润的pH试纸测稀碱液的pH,测定值偏小
B、用容量瓶配置溶液,定容时俯视刻度线,所配溶液浓度偏小
C、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D、测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小
[解析]该题考查基本实验的误差分析。A选项湿润的PH试纸测稀碱液的PH时,碱液被稀释,PH值偏小,正确。B选项用容量瓶配置溶液定容时俯视刻度线,所加水偏少,所配溶液浓度偏大,错误。C选项滴定前滴定管 内无气泡,终点读数时有气泡,所测体积偏小,液就是读数偏小,正确。D选项测定中和反应反的应热时,将碱缓慢倒入酸中,热量损失比较多,所测温度值偏小,正确。
内无气泡,终点读数时有气泡,所测体积偏小,液就是读数偏小,正确。D选项测定中和反应反的应热时,将碱缓慢倒入酸中,热量损失比较多,所测温度值偏小,正确。
答案:B
2.(2013·四川理综化学·5)室温下,将一元酸HA的溶 液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
|
实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
|
c(HA) |
c(KOH) |
||
|
① |
0.1 |
0.1 |
9 |
|
② |
x |
0.2 |
7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)= 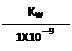 mol·L—1
mol·L—1
C. 实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D. 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
[答案]B
解析:由表中①的HA为弱酸且酸碱物质的量相等,因此得A正确;由①中电荷守恒得[OH-]=[K+]-[A-]+[H+]=Kw/1X10-9 mol/L,故B错误;C中由②得X>0.2mol/L,故C正确;由电荷守恒得D正确
1.(2013·上海化学·19)部分弱酸的电离平衡常数如下表:
|
弱酸 |
HCOOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
Ki=1.77×10-4 |
Ki=4.9×10-10 |
Ki1=4.3×10-7、Ki2=5.6×10-11 |
下列选项错误的是
A.2CN-+H2O+CO2→2HCN+CO32-
B.2HCOOH+CO32-→2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
[答案]AD
[解析]根据电离常数可酸性HCOOH>H2CO3>HCN>HCO3-,因此,A错误,B正确;等体积、等pH的HCOOH和HCN所含溶质,HCN多,则中和时消耗的NaOH的量多,C正确;根据电荷守恒,n(HCOO-)+n(OH-)=n(Na+)+n(H+),n(CN-)+n(OH-)= n(Na+)+n(H+),
即离 子总数是n(Na+)+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的n(OH-)大,n(H+)小,D错误。
子总数是n(Na+)+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的n(OH-)大,n(H+)小,D错误。
[考点定位]本题考查酸性强弱,离子浓度比较,中和反应等。
8.(2013·江苏化学·3)常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-[来源:ZXXK]
C.0.1 mol·L-1AgNO3溶液:H+、K+、SO42-、I-[来源:]
D.0.1 mol·L-1NaAlO2溶液: H+、Na+、Cl-、SO42-
7.(2013·重庆理综·7)在水溶液中能量共存的一组离子是( )
A.Na+、Ba2+、Cl-、NO3- B. Pb2+、Hg2+、S2-、SO42-
C.NH4+、H+、S2O32-、PO43- D.ClO-、Al3+、Br-、CO32-
解析:考察离子共存问题。A项,可以大量共存;B项,Pb2+、Hg2+与S2-、SO42-会形成沉淀;C项,H+与S2O32-、PO43-反应;D项,Al3+与ClO-、CO32-双水解。选择A。
8、解析:Al3+和CO32—因发生双水解而不能共存,A错误;Fe2+、H+、MnO4—因发生氧化还原反应不能共存,B错误;NH4+与OH—因生成弱电解质一水合氨而不能共存,D错误。答案:C
命题意 图:离子共存
图:离子共存
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com