
14.如图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6 mol/L的硫酸,其他试剂任选。填写下列空白:
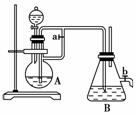
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是________。A中反应的离子方程式是___________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程:__________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为____________。
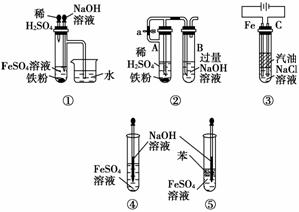
(5)下列各图示中________能较长时间看到Fe(OH)2白色沉淀。
解析: Fe+2H+===Fe2++H2↑,当关闭活塞a时,由于H2的压力使溶液压入B中,从而发生Fe2++2OH-===Fe(OH)2↓;Fe2+在空气中很容易被氧化即4Fe(OH)2+O2+2H2O===4Fe(OH)3。因此在H2的环境中就不易被O2侵入,从而可以较长时间看到Fe(OH)2白色沉淀。
答案: (1)铁屑 Fe+2H+===Fe2++H2↑ (2)打开
(3)关闭活塞a,使FeSO4溶液压入B中进行反应 (4)4Fe(OH)2+2H2O+O2===4Fe(OH)3
(5)①②③⑤
13.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:
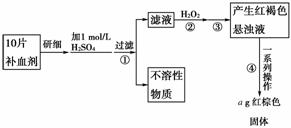
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加________ ,该过程的现象为:__________。
,该过程的现象为:__________。
(2)步骤②加入过量H2O2的目的是:________。
(3)步骤③中反应的离子方程式是:__________。
(4)步骤④中一系列 处理的操作步骤:过滤、________、灼烧、____
处理的操作步骤:过滤、________、灼烧、____ ____、称量。
____、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________g。
解析: (1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加氯水(或双氧水、稀硝酸等),若滤液由浅绿色变为红色,则说明滤液中含有Fe2+。
(2)由于H2O2具有氧化性,加入过量H2O2的目的是:将Fe2+全部氧化为Fe3+。
(3)步骤③的目的是:将Fe3+全部转化为Fe( OH)3,所以步骤③需加入过量的NaOH溶液或氨水,反应的离子方程式是:Fe3++3OH-===Fe(OH)3↓[或Fe3++3NH3·H2O===Fe(OH)3↓+3NH]。
OH)3,所以步骤③需加入过量的NaOH溶液或氨水,反应的离子方程式是:Fe3++3OH-===Fe(OH)3↓[或Fe3++3NH3·H2O===Fe(OH)3↓+3NH]。
(4)步骤④的目的是:将产生的红褐色悬浊液分离,最终得到固体Fe2O3,所以步骤④的操作步骤是:过滤、洗涤、灼烧、冷却、称量。
(5)由于实验中铁无损耗,根据铁元素守恒得,每片补血剂中m(Fe)=(÷10)g
=0.07a g。
答案: (1)氯水(或双氧水、稀硝酸等合理氧化剂) 溶液由浅绿色变为红色
(2)将Fe2+全部氧化为Fe3+
(3)Fe3++3OH-===Fe(OH)3↓[或Fe3++3NH3·H2O===Fe(OH)3↓+3NH]
(4)洗涤 冷却 (5)0.07a
12.某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了下图所示的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
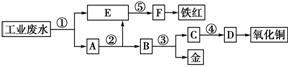
填写下面空白。
(1)图中标号处需加入的相应物质分别是①________、②________、③________、④________、⑤____________;
(2)写出①处发生反应的离子方程式_________________,
写出③处发生反应的化学方程式_________________;
(3)铁红的化学式为________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红________________;氧化铜______________。
解析: 在解此题时宜采用逆向推断法,从题中给出信息可知,首先分离的应是铁元素,所加最佳试剂应是铁屑,E中含Fe2+,铁红的成分为Fe2O3,可联想到高中学习的重要反应2Fe(OH)3Fe2O3+3H2O,试剂⑤应为可溶性碱(NaOH或氨水);当加入过量铁屑后,所得A应为固体Fe、Cu、Au的混合物,此时,只需加入稀硫酸(试剂②)后过滤可得Cu、Au的混合物B,再加入稀硝酸(试剂③)可使Cu、Au得到分离,Cu(NO3)2中加可溶性碱后过滤再热得到CuO。
答案: (1)①铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠
(2)Fe+2H+===Fe2++H2↑、2Fe3++Fe===3Fe2+、Cu2++Fe===Cu+Fe2+、2Au3++3Fe===2Au+3Fe2+ 3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作红色涂料 用作制造铜盐的原料
11.将铁粉、铜粉、FeCl3溶液、FeCl2溶液和CuCl2溶液混合于某容器中充分反应(容器不参与反应),试判断下列情况溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有____________。
(2)若CuCl2有剩余,则容器中一定有______,可能有______。
(3)若FeCl3和CuCl2都有剩余,则容器中不可能有______,一定有________。
(4)若FeCl3有剩余,则容器中不可能有________。
解析: 本题涉及的反应有:Fe+2FeCl3===3FeCl2,Fe+CuCl2===Cu+FeCl2,Cu+2FeCl3===2FeCl2+CuCl2。(1)中铁粉剩余,因铁粉能够与Fe3+、Cu2+反应,故容器中就不可能有Fe3+、Cu2+。(2)中CuCl2有剩余,则容器中一定有Fe2+。若有铜粉剩余,则 无Fe3+;若无铜粉剩余,溶液中可能有Fe3+。(3)中FeCl3和CuCl2都有剩余,容器中不可能有铁粉、铜粉,因二者都能与Fe3+反应,但一定有Fe2+。(4)中FeCl3有剩余,同理分析容器中
无Fe3+;若无铜粉剩余,溶液中可能有Fe3+。(3)中FeCl3和CuCl2都有剩余,容器中不可能有铁粉、铜粉,因二者都能与Fe3+反应,但一定有Fe2+。(4)中FeCl3有剩余,同理分析容器中 不可能有铁粉、铜粉。
不可能有铁粉、铜粉。
答案: (1)Fe3+、Cu2+ (2)Fe2+ Fe3+(或铜粉) (3)铁粉、铜粉 Fe 2+
(4)铁粉、铜粉
2+
(4)铁粉、铜粉
10.向含a g HNO3的稀溶液中,加入b g铁粉充分反应全部溶解。已知有 g HNO3被还原,则a∶b不可能是( )
A.2∶1 B.3∶1 C.4∶1 D.9∶2
解析: 利用极值法,根据化学方程式或电子守恒规律,生成Fe2+时,3Fe8HNO3===3Fe(NO3)2+2NO↑+4H2O
×3=×2,a∶b=3∶1;生成Fe3+时,根据Fe+4HNO3===Fe(NO3)3+NO↑+2H2O
×3=×3 ,a∶b=9∶2,生成Fe2+和Fe3+时介于上述两者之间,如4∶1,不可能为2∶1。
答案: A
9.某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓 度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
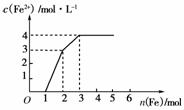
A.1∶1∶1 B.1∶3∶1 C.3∶3∶8 D.1∶1∶4
解析: 据氧化性由强到弱的顺序HNO3>Fe3+>Cu2+,可知随铁粉的增加,反应的方程式分别为:
4HNO3+Fe===Fe(NO3)3+NO↑+2H2O
4 mol 1 mol 1 mol
2Fe(NO3)3+Fe===3Fe(NO3)2
2 mol 1 mol 3 mol
Cu(NO3)2+Fe===Fe(NO3)2+Cu
1 mol 1 mol 1 mol
mol 1 mol
所以原溶液中,Fe(NO3)3、Cu(NO3)2、HNO3的物质的量之比为:(2 mol-1 mol)∶1 mol∶4 mol=1∶1∶4。
答案: D
8.为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是( )
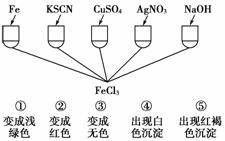
A.只有④ B.只有③ C.③和④均错 D.全部错误
答案: C
7.某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如图所示:
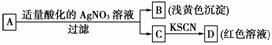
现对A、B、C、D作出的如下推断中,不正确的是( )
A.盐A一定是FeBr3 B.浅黄色沉淀B是AgBr C.滤液C中一定含Fe3+ D.D溶液中有Fe(SCN)3[来源:ZXXK]
解析: 生成浅黄色沉淀证明A中含Br-,B为AgBr,A与酸化的AgNO3溶液反应生成C,C遇KSCN生成D红色溶液,C中一定含Fe3+,A中也可能含Fe2+。
答案: A
6.向含有FeCl3和BaCl2的酸性溶液中通入足量的SO2,有白色沉淀生成,过滤后向滤液中滴入KSCN溶液时,无明显现象,由此得出的正确结论是( )
A.白色沉淀是FeSO3 B.白色沉淀是BaSO3和BaSO4的混合物
C.白色沉淀是BaSO4 D.FeCl3已全部被SO2氧化成FeCl2
解析: 2Fe3++SO2+2H2O===2Fe2++SO+4H+,由于SO2过量溶液中无Fe3+;又SO+Ba2+===BaSO4↓,而BaSO3在酸性环境不能生成,所以白色沉淀为BaSO4。
答案: C
5.某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色。下列结论正确的是( )

A.一定有Fe2+,一定没有Fe3+、Mg2+ B.一定有Fe3+,一定没有Fe2+、Mg2+
C.一定有Fe3+,可能有Fe2+,一定没有Mg2+ D.一定有Fe2+,可能有Mg2+,一定没有Fe3+
解析: 加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色的现象是溶液中含有亚铁离子的特性,若有Fe3+,则产生氢氧化铁的红褐色沉淀会掩盖Fe(OH)2的白色,所以不可能存在,而Mg(OH)2是白色,有可能存在。
答案: D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com