
4.室温下,下列各组离子在指定溶液中能大量共存的是( )
A.饱和氯水中Cl-、NO、Na+、SO
B.c(H+)=1.0×10-13 mol·L-1溶液中CH3COO-、K+、SO、Br-
C.Na2S溶液中SO、K+、Cl-、Cu2+
D.pH=12的溶液中NO、I-、Na+、Al3+
解析: A项,氯水中的Cl2能将SO氧化成SO;B项,在碱性溶液中,CH3COO-、K+、SO、Br-均可以大量共存;C项,S2-与Cu2+因形成CuS沉淀而不能大量共存;D项,在碱性溶液中,Al3+不能大量存在。
答案: B
3.下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是( )
A.Ba2+、NO、NH、Cl- B.Ca2+、HCO、NH、AlO
C.K+、Ba2+、Cl-、HSO D.Mg2+、NH、SO、K+
解析: “气体”“沉淀”是本题的关键词。A项,加入NaOH会与NH反应产生NH3,但没有沉淀;B项HCO与AlO不能大量共存,会生成Al(OH)3沉淀;C项,OH-与HSO反应生成SO,与Ba2+反应可生成BaSO3沉淀,但无气体;D项,OH-与NH反应产生NH3,与Mg2+反应会产生Mg(OH)2沉淀,正确。
答案: D
2.把0.05 mol NaOH固体分别加入到100 mL 下列液体中,溶液的导电能力变化最小的是( )
A.自来水 B.0.5 mol·L-1盐酸 C.0.5 mol·L-1CH3COOH溶液 D.0.5 mol·L-1KCl溶液
解析: 溶液混合后导电能力变化的大小,关键看混合后溶液中自由移动离子的浓度的变化。由于自来水几乎不导电,加入0.05
mol NaOH后,导电性突然增大;醋酸是弱电解质,加入NaOH后,生成强电解质CH3COONa,导电性明显增强 ;0.5 mol·L-1的KCl中加入0.05 mol NaOH固体后,溶液中不存在化学反应,但离子浓度增大一倍,导电能力增强;但盐酸中加入NaOH固体后,二者恰好中和:HCl+NaOH===NaCl+H2O,溶液中离子浓度不变,导电能力几乎不变。
;0.5 mol·L-1的KCl中加入0.05 mol NaOH固体后,溶液中不存在化学反应,但离子浓度增大一倍,导电能力增强;但盐酸中加入NaOH固体后,二者恰好中和:HCl+NaOH===NaCl+H2O,溶液中离子浓度不变,导电能力几乎不变。
答案: B
1.为防止流感病毒的传播,许多公共场所都注意环境消毒,以下消毒药品属于强电解质的是( )

答案: B
15.将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________mL。
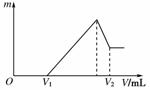
(2)若在滴加NaOH溶液 过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积
过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积 V(NaOH)=________mL。
V(NaOH)=________mL。
解析: (1)由图像可知:V1 mL的NaOH溶液是与过量H2SO4反应的,由与Mg、Al反应的H2SO4为:0.2 mol-0.16 mol×=0.12 mol。假设n(Mg)=x mol,n(Al)=y mol
则有方程组:解得:x=0.06 mol,y=0.04 mol。
当加入V2 mL NaOH溶液时,得到Mg(OH)2沉淀和NaAlO2关系式为:Mg2+~2OH-,Al3+~4OH-,
所以,V2=160 mL+×103 mL/L=440 mL。
(2)当Mg2+、Al 3+刚好沉淀完全时,溶液中只有Na2SO4,关系式为2NaOH~H2SO4,
3+刚好沉淀完全时,溶液中只有Na2SO4,关系式为2NaOH~H2SO4,
所以,V(NaOH)==400 mL。
答案: (1)0.06 440 (2)400
14.废易拉罐的成分比较复杂,据查,铝易拉罐各部分成分及含量(质量百分含量)见表:
|
|
Si |
 Fe Fe |
Cu |
Mn |
Mg |
Cr |
Zn |
Ti |
Al |
|
罐身/% |
0.3 |
0.7 |
0.25 |
0.25 |
1.0~1.5 |
— |
— |
— |
其余 |
|
罐盖/% |
0.2 |
0.35 |
0.15 |
0.2~0.5 |
4.0~5.0 |
— |
0.1 |
0.25 |
其余 |
|
拉环/% |
0.2 |
0.35 |
0.15 |
0.2~0.5 |
3.0~4.0 |
0.1 |
0.25 |
0.1 |
其余 |
为了验证罐身的组成成分,进行了如下实验:
[实验仪器与药品]
仪器:酒精灯、烧杯、试管、试管夹、漏斗、滤纸、铁圈、玻璃棒、砂纸、剪刀
药品:易拉罐、去污粉、NaOH溶液、KSCN溶液、盐酸、镁试剂、高碘酸(H5IO6,弱酸)
[实验方案]
实验预处理。将剪好的易拉罐片用砂纸打磨,除去表面的涂料层,直到光亮后用去污粉清洗干净备用。
[实验过程] 分别向试管a、b中加入少量上 述易拉罐片,进行如下操作:
述易拉罐片,进行如下操作:
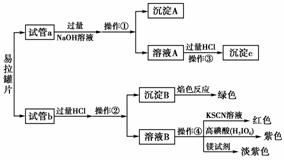
请填写下列空白:
(1)图中操作①②所用到的玻璃仪器有___________。
(2)沉淀A的成分为______________。
(3)操作③观察到的现象为_____________;
反应的离子方程式为_____________。
(4)若试管a、b中取样相同,则分别加入足量 NaOH溶液、稀盐酸后,相同条件下理论上产生的气体体积V(a)________V(b)(填“<”、“>”或“=”)。
NaOH溶液、稀盐酸后,相同条件下理论上产生的气体体积V(a)________V(b)(填“<”、“>”或“=”)。
解析: (1)操作①②为过滤,所用到的玻璃仪器为漏斗、烧杯、玻璃棒。
(2)Al、Si都溶于NaOH溶液,过滤后滤渣为Fe、Cu、Mn、Mg等金属。
(3)溶液A中含有NaAlO2、Na2SiO3,NaAlO2与盐酸反应,开始生成Al(OH)3沉淀,继而又溶解于过量的盐酸中,Na2SiO3与盐酸反应生成H2SiO3沉淀。
(4)因为NaOH溶液仅与Al、Si反应,而稀盐酸能与Al、Fe、Mg等金属反应,依据易拉罐各元素的质量分数,不难看出后者反应后放出的气体多。
答案: (1)漏斗、烧杯、玻璃棒 (2)Fe、Cu、Mn、Mg等
(3)开始生成白色沉淀,并逐渐增多,后沉淀部分溶解
H++AlO+H2O===Al(OH)3↓、
Al(OH)3+3H+===Al3++3H2O、
2H++SiO===H2SiO3↓
(4)<
13.一种高效无机水处理剂——聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m。它可通过调节AlCl3溶液的pH,促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al 2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
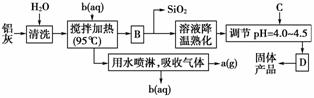
(1)搅拌加热操作过程中发生反应的离子方程式为__________________。
(2)生产过程中实验操作B、D的名称均为_____________。
(3)反应中副产品a是________,试剂b是_______________。(用化学式表示)
(4)生产过程中可循环使用的物质是________(用化学式表示)。
(5)调节pH=4.0~4.5的目的是____________。
(6)为得到较纯净的晶体,生产过程中C物质可选用____________。
A.氨水 B.NaAlO2 C.NaOH D.Al2O3 E.Al
解析: (1)搅拌加热时铝灰中的Al、Al2O3和盐酸发生反应。(2)操作B得到溶液和SiO2,操作D从溶液中分离出固体产品,均为过滤。(3)因制备的是聚合氯化铝,则b为盐酸,产生的副产品a为H2。(4)HCl可以循环使用。(5)聚合氯化铝是通过调节AlCl3溶液pH,促进其水解而结晶析出的。(6)选项中物质都能促进AlCl3水解,但A、B、C项会引入杂质离子。
答案: (1)Al2O3+6H+===2Al3++3H2O、2Al+6H+===2Al3++3H2↑ (2)过滤
(3)H2 HCl (4)HCl (5)促进AlCl3水解,使晶体析出 (6)DE
12.某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子,并尽可能减少AlCl3的损失。请回答下列问题:

(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:___________ __。
__。
氢氧化钠溶液能否用氨水代替,为什么?________________。
(2)溶液a中存在的离子有_______________;
在溶液a中加入盐酸时需控制溶液的pH,为什么?___________;
为此,改进方法是___________。
答案: (1)Mg2 ++2OH-===Mg(OH)2↓ Al3++3OH-===Al(OH)3↓
++2OH-===Mg(OH)2↓ Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO+2H2O 不能,因为Al(OH)3不能溶于过量的氨水中,不能将Al(OH)3与Mg(OH)2分开
(2)K+、Cl-、Na+、AlO、OH- 因为Al(OH)3能溶于强酸,所以需控制pH,防止部分Al(OH)3溶解 在a溶液中通入过量CO2气体
11.Al(OH)3是治疗胃酸过多的药物胃舒平的主要成分。某课外兴趣小组用铝、稀硫酸、烧碱为原料,制备一定量的Al(OH)3。他们分别设计 了两种实验方案:
了两种实验方案:
方案一:AlAl2(SO4)3Al(OH)3
方案二:AlNaAlO2Al(OH)3
(1)从节约药品的角度思考,你认为哪一种方案较好?________,方案一和方案二共同存在的问题是______________。
(2)请用相同的原料设计一个更为节约药品的方案,并写 出有关反应的化学方程式:_____________。
出有关反应的化学方程式:_____________。
答案: (1)方案二较好 第二步操作很难控制试剂用量
(2)2Al+3H2SO4===Al2(SO4)3+3H2↑;
2Al+2NaOH+2H2O===2NaAlO2+3H2↑;
Al3++3AlO +6H2O===4Al(OH)3↓
+6H2O===4Al(OH)3↓
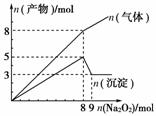
10.将Na2O2逐渐加入到含有Al3+、Mg2+、NH的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图所示,则原混合液中Al3+、Mg2+、NH的物质的量分别是( )
A.2 mol、3 mol、8 mol B.3 mol、2 mol、8 mol
C.2 mol、3 mol、4 mol D.3 mol、2 mol、4 mol
解析: 反应中生成的沉淀有Mg(OH)2、Al(OH)3,生成的气体有NH3和O2。由纵坐标及曲线n (沉淀)可知:n(Mg2+)=n[Mg(OH)2]=3
mol,n(Al3+)=n[Al(OH)3]=2
mol,产物中n(气体)在加入n(Na2O2)=8
mol前、后是两条斜率不同的直线。所以加入8
mol Na2O2前放出气体为O2和NH3的混合气,之后仅放出O2,由8
mol Na2O2与H2O反应可放出4 mol O2可知放出n(NH3)=8
mol-4
mol=4
mol=n(NH)。
(沉淀)可知:n(Mg2+)=n[Mg(OH)2]=3
mol,n(Al3+)=n[Al(OH)3]=2
mol,产物中n(气体)在加入n(Na2O2)=8
mol前、后是两条斜率不同的直线。所以加入8
mol Na2O2前放出气体为O2和NH3的混合气,之后仅放出O2,由8
mol Na2O2与H2O反应可放出4 mol O2可知放出n(NH3)=8
mol-4
mol=4
mol=n(NH)。
答案: C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com