
14.人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
(1)用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为________________________________。
(2)如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为________________________________________。
(3)有人用土法治疗胃酸过多,方法是:将鸡蛋壳洗净、烧焦、磨细服用。据说这种疗法效果还不错。请用学过的知识分析其中的道理。____________________________________________
_______________________________________。
(4)氢氧化钠也能中和胃酸,为什么不用氢氧化钠来治疗胃酸过多?
_________________ ______________________________________________
______________________________________________ _________。
_________。
解析: 胃酸的主要成分是盐酸,NaHCO3、Al(OH)3、鸡蛋壳(主要成分是CaCO3)均能与HCl反应,起到降低胃酸的作用,NaOH虽然也能中和胃酸,但由于其具有强烈的腐蚀性,会严重损伤消化道,故不能用NaOH来治疗胃酸过多。
答案: (1)HCO+H+===CO2↑+H2O
(2)Al(OH)3+3H+===Al3++3H2O
(3)鸡蛋壳中含CaCO3,洗净是为了除杂物,烧焦主要是杀菌、消毒,服用后,CaCO3与HCl反应起到了降低HCl浓度的作用,CaCO3+2H+===Ca2++CO2↑+H2O
(4)NaOH具有强烈的腐蚀性,会严重损伤消化道
13.向含有Mg2+、Fe2+、Al3+、NH四种离子的溶液中加入过量的NaOH溶液,微热并搅拌(考虑空气中的氧气氧化作用),再加入过量的盐酸后,上述阳离子大量减少的是__________。加入盐酸之前溶液中发生反应的所有离子方程式为____________________________________________。
答案: Fe2+、NH
Mg2++2OH-===Mg(OH)2↓,Fe2++2OH-===Fe(OH)2↓,4Fe(OH)2+O2+2H2O===4Fe(OH)3,Al3++4OH-===AlO+2H2O,NH+OH-NH3↑+H2O
12.甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含离子如表所示:
|
阳离子 |
NH、Na+、Mg2+ |
|
阴离子 |
OH-、NO、SO |
取等质量的三种化合物配制相同体积的溶液,其溶质物质的量浓度:c(甲)>c(乙)>c(丙),①MgSO4 ②NaOH ③(NH4)2SO4 ④Mg(NO3)2⑤NH4NO3 ,则乙物质可能是( )
A.①② B.③④ C.③⑤ D.①⑤
解析: 根据均为可溶性强电解质可知OH-只能与Na+结合。根据三种溶液浓度的关系可知摩尔质量M(甲)<M(乙)<M(丙),故甲是NaOH,则乙可能是NH4NO3或(NH4)2SO4,故选C。
答案: C
11.欲将混合液中Al3+、Cu2+、Ba2+、Ag+逐一沉淀出来加以分离,加入试剂①Cl- ②SO ③OH- ④CO2 ⑤CO的正确顺序是( )
A.①②③④ B.③⑤①② C.②①③⑤ D.①⑤③②
解析: Cl-仅和Ag+生成沉淀,SO能和Ba2+、Ag+生成沉淀,OH-能和Al3+、Cu2+、Ag+生成沉淀,CO能和Al3+、Cu2+、Ba2+、Ag+都能生成沉淀,故先加Cl-,再加SO,再加过量的OH-,最后再通入CO 2,使AlO生成沉淀。
2,使AlO生成沉淀。
答案: A
10.某溶液中大量存在如下五种离子:NO、SO、Fe3+、H+、M,它们的物质的量之比 依次为n(NO)∶n(SO)∶n(Fe3+)∶n(H+)∶n(M)=2∶
依次为n(NO)∶n(SO)∶n(Fe3+)∶n(H+)∶n(M)=2∶ 3∶1∶3∶1,则M可能是( )
3∶1∶3∶1,则M可能是( )
A.Al3+ B.Mg2+ C.CO D.Ba2+
解析: 因2×(-1)+3×(-2)-(3×1+1×3)=-2,所以M为二价阳离子;而Ba2+与SO不能大量共存。
答案: B
9.下表中评价合理的是( )
|
选项 |
化学反应及其离子方程式 |
评价 |
|
A |
Fe3O4与稀硝酸反应:2Fe3O4+18H+===
6Fe3++H2↑+8H2O |
正确 |
|
B |
向碳酸镁中加入稀盐酸:CO+2H+===CO2↑+H2O |
错误,碳酸镁不应写成离子形式 |
|
C |
向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO===BaSO4↓ |
正确 |
|
D |
FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2 |
错误,Fe2+与Br-的化学计量数之比应为1∶2 |
解析: A项不正确 ,NO应参与反应;C项不正确,NH与OH-也能反应;D项,评价不正确,FeBr2溶液与等物质的量的Cl2反应,Br-只能部分参与反应,Fe2+与Br-的化学计量数之比为1∶1。
,NO应参与反应;C项不正确,NH与OH-也能反应;D项,评价不正确,FeBr2溶液与等物质的量的Cl2反应,Br-只能部分参与反应,Fe2+与Br-的化学计量数之比为1∶1。
答案: B
8.(创新题)下列各选项中的两个反应,可用同一个离子方程式表示的是( )
|
选项 |
Ⅰ |
Ⅱ |
|
A |
Ba(OH)2溶液与过量NaHCO3溶液混合 |
NaOH溶液与过量NaHCO3溶液混合 |
|
B |
少量SO2通入Ba(OH)2溶液中 |
过量SO2通入Ba(OH)2溶液中 |
|
C |
BaCl2溶液与Na2SO3溶液混合 |
Ba(NO3)2溶液与H2SO3溶液混合 |
|
D |
少量氨水滴入AlCl3溶液中 |
少量AlCl3溶液滴入氨水中 |
解析: 各项反应的离子方程式如下:
|
|
Ⅰ |
Ⅱ |
|
A |
Ba2++2OH-+2HCO===BaCO3↓+CO+2H2O |
OH-+HCO===CO+H2O |
|
B |
Ba2++2OH-+SO2===BaSO3↓+H2O |
OH-+SO2===HSO |
|
C |
Ba2++SO=== |
|
|
BaSO3↓ |
3Ba2++2NO+3H2SO3===4H++3BaSO4↓+2NO↑+H2O |
|
|
D |
Al3++3NH3·H2O===Al(OH)3↓+3NH |
|
答案: D
7.铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如下图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
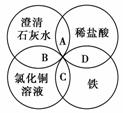
A.OH-+HCl===H2O+Cl- B.Ca(OH)2+Cu2+===Ca2++Cu(OH)2
C.Fe+Cu2+===Cu+Fe2+ D.Fe+2H+===Fe3++H2↑
解析: A项为盐酸与澄清石灰水反应的离子方程式,应为H++OH-===H2O;B项为澄清石灰水与CuCl2溶液的反应,应为2OH-+Cu2+===Cu(OH)2↓;C项为CuCl2溶液与Fe的反应;D项为Fe与盐酸的反应,应为Fe+2H+===Fe2++H2↑。
答案: C
6.能正确表示下列反应的离子方程式是( )
A.硫酸铝溶液中加入过量氨水Al3++3OH-===Al(OH)3↓
B.碳酸钠溶液中加入澄清石灰水Ca(OH)2+CO===CaCO3↓+2OH-
C.冷的氢氧化钠溶液中通入氯气Cl2+2OH-===ClO-+Cl-+H2O
D.稀硫酸中加入铁粉2Fe+6H+===2Fe3++3H2↑
解析:离子方程式书写的正误判断至少应注意以下三个方面:(1)反应本身是否符合反应实际;(2)反应是否遵循质量守恒、元素守恒和电荷守恒;(3)离子或分子的符号是否遵循书写规律。A.氨水为弱电解质,应写分子式NH3·H2O,故A错。B.澄清石灰水中Ca(OH)2应写成离子形式,正确的写法为:Ca2++CO===CaCO3↓。D.铁和稀硫酸的反应产物为Fe2+,应写为Fe+2H+===Fe2++H2↑。故选C。
答案: C
5.下列对各组离子或物质是否能够大量共存解释正确的是( )
|
A |
常温常压下NH3、O2、H2、CO2 |
不能 |
|
共存 |
NH3为碱性气体、CO2为酸性气体,二者反应生成(NH4)2CO3 |
|
|
B |
c(OH-)=1.0×10-13 mol/L溶液中,Fe2+、NO、SO、Na+ |
不能 |
|
共存 |
发生反应:3Fe2++NO+4H+===3Fe3++NO↑+2H2O |
|
|
C |
溶液中:K+、Cu2+、Cl-、NH3·H2O |
不能 |
|
共存 |
发生反应:Cu2++2OH-===Cu(OH)2↓ |
|
|
D |
溶液中:Al3+、 Na+、SO、HCO Na+、SO、HCO |
可以 |
|
共存 |
不能 发生反应 发生反应 |
|
解析: 常温常压下,A项中四种物质可以共存;C项中NH3·H2O是弱电解质,在离子方程式中应写成化学式,不能拆开;D项中Al3+与HCO发生双水解反应生成氢氧化铝与二氧化碳而不能共存。
答案: B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com