
7.R2O在一定条件下可以把Mn2+氧化成MnO,若反应中R2O变为RO,又知反应中氧化剂与还原剂的物质的量之比为5∶2,则n值为( )
A.1 B.2 C.3 D.4
解析: 根据电子守恒,2 mol Mn2+→2 mol MnO,失2×5 mol=10 mol e-,所以每1 mol R2O→2 mol RO得2 mol e-,故可知R2O中R的化合价为+7。因此n=2。
答案: B
6.硫代硫酸钠可作为脱氯剂,已知25.0 mL 0.100 mol·L-1 Na2S2O3溶液恰好把224 mL(标准状况下) Cl2完全转化为Cl-,则S2O将转化成( )
A.S2- B.S C.SO D.SO
解析: 设m为氧化产物与Na2S2O3中硫元素的化合价之差,由得失电子守恒得:0.224 L÷22.4 L·mol-1×2×1=0.025 L×0.100 mol·L-1×2×m,m=4。Na2S2O3中S为+2价,被Cl2氧化后,上升4价,变为+6价,得到SO。
答案: D
5.NaNO2是一种食品添加剂,它能致癌。酸性高锰酸钾溶液与亚硝酸钠的反应方程式是:MnO+NO+―→Mn2++NO+H2O。下列叙述中正确的是( )
A.该反应中NO被还原 B.反应过程中溶液的pH变小
C.生成1 mol NaNO3需要消耗0.4 mol KMnO4 D.中的粒子是OH-
解析: 反应中氮元素的化合价从+3价升高到+5价,失去2个电子,被氧化,作还原剂,A不正确;Mn元素的化合价从+7价降低到+2价,得到5个电子,根据电子得失守恒可知,氧 化剂和还原剂的物质的量之比是2∶5,所以选项C正确;再根据电荷守恒可知,反应前消耗氢离子,所以B和D都是错误的,答案为C。
化剂和还原剂的物质的量之比是2∶5,所以选项C正确;再根据电荷守恒可知,反应前消耗氢离子,所以B和D都是错误的,答案为C。
答案: C
4.已知OCN-中每种元素都满足8电子稳 定结构,在反应OCN-+OH-+Cl2―→CO2+N2+Cl-+H2O(未配平)中,如果有6
mol Cl2完全反应,则被氧化的OCN-的物质的量是( )
定结构,在反应OCN-+OH-+Cl2―→CO2+N2+Cl-+H2O(未配平)中,如果有6
mol Cl2完全反应,则被氧化的OCN-的物质的量是( )
A.2 mol B.3 mol C.4 mol D.6 mol
解析: OCN-中C显+4价,N显-3价,反应中只有N和Cl的化合价改变,根据OCN-N2、Cl22Cl-,由得失电子守恒:2n(Cl2)=3n(OCN-),可知6 mol Cl2完全反应,有4 mol OCN-被氧化,C对。
答案: C
3.一未完成的离子方程式________+XO+6H+===3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为( )
A.1∶1 B.3∶1 C.5∶1 D.7∶1
 解析: 由质量守恒和电荷守恒可得出该离子反应方程式为5X-+XO+6H+===3X2+3H2O,则氧化产物和还原产物的物质的量之比为5∶1。
解析: 由质量守恒和电荷守恒可得出该离子反应方程式为5X-+XO+6H+===3X2+3H2O,则氧化产物和还原产物的物质的量之比为5∶1。
答案: C
2.含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2===2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2===Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-
解析: 根据氧化还原反应的先后顺序知,Cl2先氧化Fe2+,然后再氧化Br-。x=0.4a时,Cl2不能完全氧化Fe2+,只能发生反应2Fe2++Cl2===2Fe3++2Cl-,A项正确;当x=0.6a时,Cl2能将Fe2+完全氧化后,又能氧化的Br-,故B错误;x=a时,Cl2氧化Fe2+后又能氧化a mol的Br-,C正确;x=1.5a时,Cl2能将Fe2+、Br-完全氧化,D正确。
答案: B
1.在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是( )
A.Mg B.Cu C.Ag D.H2[来源:]
解析: 根据氧化还原反应的优先规律,一种还原剂与多种氧化剂反应时,氧化性较强的首先被还原。根据金属活动性规律顺序表,氧化性强弱顺序为Ag+>Cu2+(>H+)>Zn2+>Mg2+,故首先被置换出来的是Ag。
答案: C
17.某电镀铜厂有两种废水需要处理,一种废水中含有CN-,另一种废水中含有Cr2O。该厂拟定如图所示的废水处理流程。
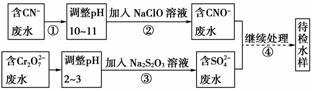
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是_________ _。
_。
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因____________________。
(3)②中反应后无气体放出,该反应的离子方程式为_________________________。
(4)③中反应时,每0.4 mol Cr2O转移2.4 mol e-,该反应的离子方程式为________________。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少。请你使用化学用语,结合必要的文字解释其原因____________________________________。
解析: (3) 反应后无气体放出说明ClO-被还原生成Cl-,没有产生Cl2。
反应后无气体放出说明ClO-被还原生成Cl-,没有产生Cl2。
(4)每0.4 mol Cr2O转移2.4 mol e-,说明Cr元素被还原后生成了Cr3+。
答案: (1)氧化还原法
(2)ClO-+H2OHClO+OH-
(3)CN-+ClO-===CNO-+Cl-
(4)3S2O+4Cr2O+26H+===6SO+8Cr3++13H2O
(5)待检水样中含有 Cu2+
Cu2+
Cu2++2OH-===Cu(OH)2↓
Cu(OH)2(s)+S2-(aq)===CuS(s)+2OH-(aq)
[或Cu(OH)2Cu2++2OH-,Cu2++S2-===CuS↓]
CuS比Cu(OH)2更难溶(或溶解度更小)
16.A、B、C、D、E均是由下列离子组成的可溶性化合物。组成这五种物质的离子有(离子不能重复组合):
|
阳离子 |
Na+ Mg2+ Al3+ Ba2+ Fe3+ |
|
阴离子 |
OH- Cl- CO SO HCO |
分别取它们进行实验,结果如下:
①A溶液与D溶液混合,没有明显现象;
②当B溶液加入到D溶液中时,有沉淀产生。继续加入B溶液,沉淀全部消失。
③将E溶液加热, 有沉淀生成。
有沉淀生成。
据此推断:A____________;B____________;C____________;
D____________;E____________(填化学式)。
解析: 该题抓住“可溶性化合物”说明五种物质均溶于水;根据当B溶液加入到D溶液中时,有沉淀产生。继续加入B溶液,沉淀全部消失,可推测是铝盐与强碱溶液反应的特征现象。
答案: Fe2(SO4)3 Ba(OH)2 Na2CO3 AlCl3 Mg(HCO3)2
15.向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式___________________________________________。
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液中显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
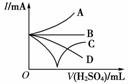
(3)若缓缓加入稀硫 酸直至过量,整个过程中混合溶液的导
酸直至过量,整个过程中混合溶液的导 电能力(用电流强度I表示)可近似地用右图中的________曲线表示(填序号)。
电能力(用电流强度I表示)可近似地用右图中的________曲线表示(填序号)。
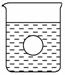
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将____________。
答案: (1)Ba2++2OH-+SO+2H+===BaSO4↓+2H2O
(2)A
(3)C
(4)沉到烧杯底部
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com