
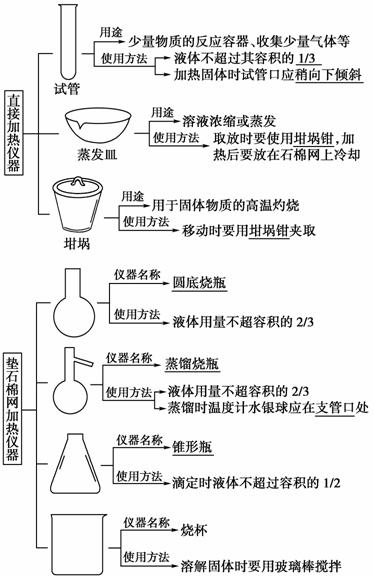
2.计量仪器
(1)
(2)
(3)
(4)
(5)
1. 可加热仪器
15.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3的反应方程式。
(2)已知:Se+2H2SO4(浓) ===2SO2↑+SeO2+2H2O
===2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O===Se+2SO+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是____________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3―→Se+I2+KNO3+H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.150 0 g,消耗0.200
0 mol·L-1的Na2S2O3溶液25 .00 mL,所测定的样品中SeO2的质量分数为________。
.00 mL,所测定的样品中SeO2的质量分数为________。
解析: (1)根据已知反应物和生成物并根据电子得失守恒和质量守恒定律可知,反应的化学方程式是Se+2HNO3(浓)===H2SeO3+NO↑+NO2↑。
(2)在氧化还原反应中氧化剂的氧化性大于氧化产物的,所以根据反应的化学方程式可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2。
(3)在反应①中Se元素的化合价从+4价降低到0价,而碘元 素的化合价从-1价升高到0价,所以根据电子的得失守恒,配平后的方程式是SeO2+4KI+4HNO3===Se+2I2+4KNO3+2H2O。
素的化合价从-1价升高到0价,所以根据电子的得失守恒,配平后的方程式是SeO2+4KI+4HNO3===Se+2I2+4KNO3+2H2O。
(4)根据反应①②及电子的得失守恒可知,SeO2~4Na2S2O3,所以参加反应的SeO2的物质的量是0.200 0 mol·L-1×0.025 L÷4=0.001 25 mol,因此所测定的样品中SeO2的质量分数为×100%=92.5%。
答案: (1)Se+2HNO3(浓)===H2SeO3+NO↑+NO2↑ (2)H2SO4(浓)>SeO2>SO2
(3)SeO2+4KI4e-+4HNO3===Se+2I2+4KNO3+2H2O (4)92.5%
14.(创新题)新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。生产K2FeO4的工艺流程如下图所示:
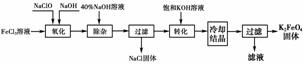
(1)完成“氧化”过程中反应的化学方程式:
FeCl3+____NaOH+____NaClO→____Na2FeO4+____+____。其中氧化剂是________(填化学式)。
(2)“转化”过程中发生反应的化学方程式为__________________________。
解析: (1)反应中NaClO是氧化剂,还原产物是NaCl,根据元素守恒,可知反应式中需要补充NaCl和H2O。根据化合价升降法配平方程式为:2FeCl3+10NaOH+3NaClO===2Na2FeO4+9NaCl+5H2O。
(2)根据(1)中反应的化学方程式和“转化”后最终得到的产物,可知“转化”过程是在加入KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4。
答案: ( 1)2 10 3 2 9 NaCl 5 H2O NaClO
1)2 10 3 2 9 NaCl 5 H2O NaClO
(2)Na2FeO4+2KOH===K2FeO4+2NaOH
13.已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红 色褪去。现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
色褪去。现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是__ ________。
________。
(2)写出一个包含上述七种物质的氧化还原反应方程式__________________________。
(3)上述反应中,氧化剂是________,1 mol氧化剂在反应中________(填“得到”或“失去”)________mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,说出NaBiO3的一个性质:____________________。
解析: (1)反应原理为:在酸性条件下,KMnO4将Cl-氧化为Cl2,自身被还原。
(2)由(1)可知反应物为KMnO4、KCl、H2SO4,其余四种物质为生成物。
(4)中溶液又显紫红色,说明NaBiO3将Mn2+氧化成了MnO,因而说明NaBiO3的氧化性比KMnO4强。
答案: (1)KCl H2SO4 (2)2KMnO4+10KCl+8H2SO4===6K2SO4+2MnSO4+5Cl2↑+8H2O
(3)KMnO4 得到 5 (4)NaBiO3具有强氧化性(比KMnO4氧化性强)
12.在热的稀硫酸中溶解了11.4 g FeSO4固体,当加入50 mL 0.5 mol·L-1 KNO3溶液时,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体。
(1)推算出x=________;y=________。
(2)配平该反应的方程式:
______FeSO4+______KNO3+____ __H2SO4===______K2SO4+______Fe2(SO4)3+______(NxOy)+______H2O(配平时x、y用具体数值表示,物质填在中)。
__H2SO4===______K2SO4+______Fe2(SO4)3+______(NxOy)+______H2O(配平时x、y用具体数值表示,物质填在中)。
(3)反应中氧化产物是__________。
(4)用双线桥法表示该反应中的电子转移方向和数目:____________________________________________________________ ____________。
____________。
解析: n(FeSO4)==0.075 mol,
n(KNO3)=0.05 L×0.5 mol·L-1=0.025 mol。
设NxOy中N元素的化合价为z
根据电子守恒:1×0.075=0.025(5-z),得z=2,即NO降低了3价而转化为NO,故y=1。
答案: (1)1 1 (2)6 2 4 1 3 2 NO↑ 4 (3)Fe2(SO4)3
(4) 6FeSO4+2KNO3+4H2SO4===K2SO4+3F失6×e-e2(SO4)3+2N得2×3e-O↑+4H2O
11.L、M、R、P、Q分别代表五种含不同化合价的氮元素的物质。A、B分别代表两种含不同化合价的氯元素的物质(每种物质中氮或氯元素的化合价只有一种)。又知物质M中的氮元素化合价要比物质Q中氮元素的化合价低。在一定条件下,它们会发生如下的转化(关系式未配平):
①P+A―→Q+B ② L+O2―→M+H2O ③L+M―→R+H2O ④B+H2O―→A+O2
L+O2―→M+H2O ③L+M―→R+H2O ④B+H2O―→A+O2
(1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是_______,理由是__________________。
(2)反应②必须在催化剂(铂、氧化铁等)作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途,据此推断在同温同压下,若物质R密度比空气的密度小,则R的化学式为________。
(3)某同学写出下面三个含氮的物质相互转换的关系式:
Ⅰ.M+P―→N2O3+H2O Ⅱ.N2O4+H2O―→P+Q Ⅲ.M+L―→Q+H2O
其中一定不可能实现的是________,理由是_____ ___________________________________。
___________________________________。
答案: (1)P P中氮元素的化合价最高 (2)N2 (3)Ⅲ 根据氧化还原反应规律,M、L这两种物质反应,不可能生成氮元素价态比M、L都高的物质
10.Cu2S 与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物中n(NO2)∶n(NO)=1∶1时,下列说法正确的是( )
与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物中n(NO2)∶n(NO)=1∶1时,下列说法正确的是( )
A.产物中n[Cu(NO3)2]∶n[CuSO4]=1∶1 B.参加反应的n(Cu2S)∶n(HNO3)=1∶5
C.反应中Cu2S既作氧化剂,又作还原剂 D.1 mol Cu2S参加反应时有8 mol电子转移
解析: 根据题意可写出反应的化学方程式为2Cu2S+14HNO3===2Cu(NO3)2+2CuSO4+5NO2↑+5NO↑+7H2O,据此 可知A正确、B错误。反应中Cu2S只作还原剂,C错误。1
mol Cu2S参加反应时有10 mol电子转移,D错误。
可知A正确、B错误。反应中Cu2S只作还原剂,C错误。1
mol Cu2S参加反应时有10 mol电子转移,D错误。
答案: A
9.已知:①向KI溶液中通入过量Cl2会有KIO3生成;②向酸化的KI与KIO3混合液中滴加淀粉溶液会变蓝色。下列有关说法正确的是( )
A.I-只具有还原性,IO只具有氧化性
B.由①②可知氧化性的强弱顺序为Cl2>I2>IO
C.①中发生反应的离子方程式为3Cl2+I-+3OH-===IO+6Cl-+3H+
D.反应②中若有5 mol e-转移,则生成3 mol单质I2
解析: IO中碘元素的化合价为+5,所以IO既具有氧化性又具有还原性,A不正确;氧化性的强弱顺序为Cl2>IO>I2,B不正确;C项离子方程式中,OH-生成H+不符合事实,不正确;反应②的离子方程式为IO+5I-+6H+===3I2+3H2O,故5 mol e-转移生成3 mol I2,故D正确。
答案: D
8.向含有1 mol FeCl2的溶液中通入0.2 mol Cl2,再加入含0.1 mol X2O的酸性溶液,使溶液中Fe2+恰好全部被氧化,并使X2O还原为Xn+,则n值为( )
A.2 B.3 C.4 D.5
解析: 由题意知,0.2 mol Cl2和0.1 mol X2O的酸性溶液,共同将1 mol Fe2+氧化。根据氧化还原反应中得失电子守恒可知,0.2 mol Cl2和0.1 mol X2O得到电子的物质的量与1 mol Fe2+失去电子的物质的量相等,所以有0.2 mol×2+0.1 mol×2×(6-n)=1 mol×1,解得n=3。
答案: B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com