
(3)取溶解后的溶液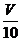 mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)
。
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定 (填选项编号)。
A.需要 B.不需要 C.均可
问题3:碳酸钙纯度计算公式 。
[方案III](1)称取碳酸钙样品 M g;
(2)高温(
问题1:为什么要煅烧至
;
问题2:本方案中的“冷却”应如何操作
。
[方案IV](1)称取碳酸钙样品 M g;
(2)加入足量Cmol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量C′mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题1:此方案中不需要的数据是 (填选项编号)。
A.C、V B.C′、 V′ C. M′ D. M
问题2:为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液体积V′ mL
B.精确配制浓度C′mol/LNa2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤也应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钠纯度将
(偏高、偏低、无影响)。
综上所述,你认为4个方案中,最好的方案是 ,其它方案的缺点分别是:
。
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案 ; 。
方案 ; 。
五、计算(8分)
22.(14分)
为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题。
[方案I](1)称取碳酸钙样品 M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积 V mL。
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (偏高、偏低、无影响)
[方案II](1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸 V mL(过量)溶解样品;
 (4)1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如图。阴极的电极反应式为
。
(4)1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如图。阴极的电极反应式为
。
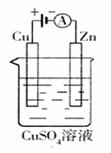 (2)右图是一个电化学过程示意图。
(2)右图是一个电化学过程示意图。
①锌片上发生的电极反应是
②假设使用肼―空气燃料电池作为本过程中的电源,铜片的质量变化
L(假设空气中氧气体积含量为20%)
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(
21.(10分)
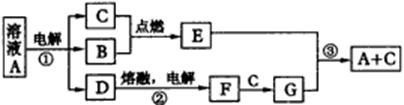
?
各物质间的转化关系
根据上图所示转化关系回答:
??(1)经测定G属于离子化合物,其电子式为___________。
??(2)写反应②的电极反应式:
? 阳极___________ ; 阴极___ 。
??(3)反应③的化学方程式为 ___________ 。
??(4)这七种物质中含有共价键的有___________ (用化学式回答)。
20.(12分)
A、B、C、D、E、F、G是由短周期元素组成的七种物质,其中B、C、F是单质;常温下B、C、E为气体;A物质的焰色反应呈黄色。(下图中反应②的部分产物未表示出来。)
(3)在上述条件下,将1molSO2和0.5molO2充入某密闭容器中,放出的热量________(填“大于”、“小于”或“等于”)98.3kJ。
接触法制硫酸的某阶段的反应为:2SO2 +
O2 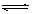 2SO3 ;△H= -196.6kJ/mol。
2SO3 ;△H= -196.6kJ/mol。
(1)该反应在___________(填一种设备)中进行,这种设备中部的装置叫_________,其作用是_______________________________________。
(2)在实际生产中,为实现较快的反应速率及较大的转化率,采用的条件是______________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com