
2.10电子、16电子和18电子的微粒之间的转化关系;
1.化学工业(石灰工业、玻璃工业、氯碱工业、电镀工业、合成氨工业生产、硫酸工业、石油化工、农副产品化工)及其用途;
【答案】(1)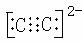 NH4++HCO3―+2OH―=NH3?H2O+CO32―+H2O
NH4++HCO3―+2OH―=NH3?H2O+CO32―+H2O
(2)1mol(3分) ; C2H6 (3分) ;沸点:HF>HCl 酸性HCl>HF
题型二 无机框图推断
以元素化合物知识为载体,考查学生的综合能力为主。强调学科内综合,命题时可能会结合概念理论、有机、实验、计算等内容进行综合设计和设问;答题时强调化学用语的正确表达,如元素符号、物质名称、化学式、化学方程式、离子方程式等。命题可能会适当体现试题的开放性和发散性,同样的信息答案却不唯一,从而考查学生的发散思维和创新能力。
09预测:
热点重点落实:
(4)①弱;若Z为强酸则在pH=7是刚好完全反应,体积消耗Z溶液12.5mL,而现在是13ml,说明生成的强碱弱酸盐。 ②否 AB (5)CaC2+2H2O →C2H2↑+Ca(OH)2
【原创6】(15分)有X、Y、Z、W四种短周期元素原子序数依次增大,它们之间可以同时相互形成A2B2型、AB型、A2型、A22―型等具有相同电子数的微粒。
(1)当A2型微粒为空气的主要成分时:
①写出上述A22―型微粒电子式 _______________。
②写出四种元素原子按5:1:1:3形成的离子化合物与足量NaOH反应的离子方程式_______________。
(2)当A2型微粒为最活泼的单质时:
①1mol A2B2型化合物分解转移电子的物质的量为_______。
②任写出一种具有相同电子的其他非极性分子的有机物化学式__________
③比较Z与W两种元素的氢化物的沸点与水溶液的酸性。沸点________________酸性______________。
【解析】本题是参考2007年全国Ⅱ卷26题和2009年考试大纲,创造设计的。本题的元素推断以电子数为特征,重点以元素化合物知识为学科内综合的载体,落实基本概念、基本理论、化学计算。以“A2”型分子为突破口。常见的由短周期元素形成的A2型分子有5种:H2、N2、O2、F2、Cl2然后进行变换推导。如果当A2型微粒为空气的主要成分时,可假设电子数为14,那么A2型分子为N2,AB型分子为CO,A2B2型分子为C2H2(电子数N相当于CH),因为制备乙炔的离子化合物碳化钙中存在C22―离子也是14电子,所以X、Y、Z、W四种短周期元素依次为H、C、N、O。若为16电子,找不到A2B2微粒。当A2型微粒为最活泼的单质时,那么A2型分子为F2,则这些微粒的电子数为18,A2B2型分子为H2O2(电子数F相当于OH),O22―也是含有18电子,AB型分子为HCl,X、Y、Z、W四种短周期元素依次为H、O、F、Cl。
【答案】(1)C (2)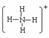 (3)
(3)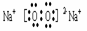
E、I、G组成NaOH与E、F、I组成的一元酸Z中和,若Z为强酸,恰好反应(pH=7)时,消耗酸体积应该为12.5mL,而题中反应至中性时消耗Z的体积为13mL,所以生成强碱弱酸盐。二者恰好反应的点位于AB区间。
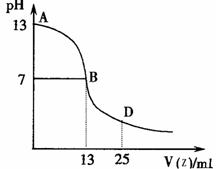
①上图能确定Z为 (“强”或“弱”)酸,理由是
②B点溶液呈中性,有人据此认为,在B点时W与Z恰好完全反应,这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)。
(5)写出Q与R之间的化学反应方程式 。
【解析】首先根据题给信息推断元素。F元素形成的化合物种类是所有元素中最多的,F为碳元素,F、H、I为同周期相邻的三种元素,依次为碳、氮、氧。E、G同主族,I、G简单离子具有相同的电子层结构,E为氢,G为钠,K与F形成离子化合物Q,与碳元素形成离子化合物的元素为钙,离子化合物为碳化钙(Q),与水(R)反应生成乙炔。
六种元素原子半径大小关系:Ca>Na>C>N>O>H,第三大为碳元素(回答元素符号),E与H组成阳离子NH4+(回答结构式),I、G组成含有两种化学键的化合物Na2O2(回答电子式),Q与R反应制备乙炔(回答化学方程式)。
(4)下图为常温下向25mL 0.1 mol?L-1 由E、I、G组成的化合物W溶液中逐滴滴加0.2 mol?L-1E、F、I组成相对分子质量为60的一元酸Z溶液过程中溶液pH的变化曲线。
【解析】本题考查有机物组成与结构知识。100×53.33%÷16==3.33 130×53.33%÷16==4.33,所以分子中含有4个O原子,A的相对分子质量为16×4÷53.33%=120,计算碳氢原子个数(120-16×4)÷12=4……8,所以该有机物分子式为C4H8O4.根据分子不饱和程度知道,分子中最多含有一个不饱和键,所以最多含有一个碳氧双键。
【答案】A
题型一 元素推断
在高考题中通常有两大类:一类是确定“指定几种元素形成化合物”的形式,该类题一般是给出几种元素的原子结构或性质特征,判断它们形成化合物的形式。解此类题的方法思路是:定元素(熟练掌握1-20号元素原子结构示意图或相关的等电子阴阳简单离子,一般出现较多的元素碳、氢、氧、氮、钠、镁、铝,其次是硅、磷、氟、氯、硫、钙),推价态(注意变价、无正价、无负价的特殊元素),想可能(联想中学化学中最常见最典型的物质及化学反应),得化学式(注意化学符号书写的规范);另一类是由“位构性”关系或元素化合物性质推断元素,解该类题的方法思路是:抓住有效的突破口,要灵活运用分析归纳演绎的思维方法,快速准确解答,而且答题时要注意化学用语的规范。
利用元素周期表解答元素推断题:最原始方法往往是最有效的方法――把短周期的元素写在稿子上去核对。重点掌握3种类型:文字推理型、表格型、实验装置兼表格推理综合型。
【原创5】现有E、F、H、I、G、K六种原子序数依次增大的前四周期主族元素,且分属四个不同周期,E、G同主族,F、H、I为同周期相邻的三种元素,其中F元素形成的化合物种类是所有元素中最多的,I、G简单离子具有相同的电子层结构,K与F形成的离子化合物Q与E和I形成的常见共价化合物R之间的反应是实验室常见的可燃气体制备原理。(题中的字母只代表元素代号,与实际元素符号无关),请回答下列问题:
(1)E~K六种元素原子,原子半径第三大的是 (填对应的元素符号,下同)。
(2)E与H两种元素组成一种阳离子,该离子的结构式为 。
(3)I、G两种元素组成含有两种化学键的化合物,该化合物的电子式为 。
【原创4】某有机化合物A的相对分子质量大于100,小于l30。经分析得知,其中碳和氢的质量分数之和为46.66%,其余为氧,则该化合物分子中最多含碳氧双键的个数为( )
A.1 B.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com