
⑶ 3Fe+4H2O(g)
 Fe3O4+4H2
(2分)
Fe3O4+4H2
(2分)
【解析】NaCl溶液涉及的工业生产为侯氏制碱,G为NaHCO3,H为Na2CO3,I为NH4Cl。A是一种含两种元素组成的液态有机溶剂,A和B反应前后气体体积(常温常压)保持不变,A为CS2,B为氧气,反应CS2+3O2=CO2+2SO2反应前后气体体积不变,所以C为CO2,D为SO2,式量关系M(SO2)= Fe3O4+4H2。图为铜和硫酸反应制H2不能自发完成,故反应只有通过电解才可能完成。铜作阳极,硫酸为电解质溶液。
Fe3O4+4H2。图为铜和硫酸反应制H2不能自发完成,故反应只有通过电解才可能完成。铜作阳极,硫酸为电解质溶液。
【答案】⑴CS2(2分)
⑵ NaCl+CO2+H2O+NH3 NaHCO3↓+NH4Cl(2分) 联合制碱法或侯氏制碱法(1分)
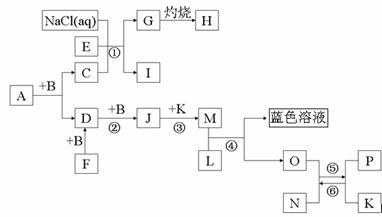
⑴A的化学式___________。
⑵写出反应①的化学方程式_______________________________。
在工业上叫______________
⑶高温下反应⑤⑥互为可逆反应,写出反应⑥的化学方程式___________________
(4)写出在加热条件下单质F与单质L的化学反应方程式___________________________。
(5)请设计一个实验方案,完成反应④,并在答题卡指定位置绘出实验装置图。
(3)
3Fe+4H2O(g)  Fe3O4+4H2
(3分)
Fe3O4+4H2
(3分)
(4) 加少量KClO3,插上镁条并将其点燃(2分),
焊接钢轨(制高熔点金属)(其他合理答案也给分)(2分)
(5) 2H2O+2e-=2OH-+H2↑(3分)
【原创7】(14分)已知A是一种含两种元素组成的液态有机溶剂,N带有磁性,B、F、L、O、P是中学化学常见单质, B、D、F、J都含有一种相同的元素且它们的相对分子质量关系是M(D)=
【原创6】 (15分)物质之间的转化关系如下图,其中A、D、E、F、H为常见单质,其余为化合物,且单质E和单质F在点燃或加热的条件下生成淡黄色的固体,B常温下为液态化合物。 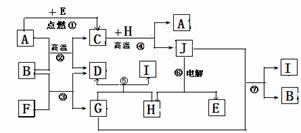
试回答下列有关问题:
(1)A在元素周期表的位置 周期 族
(2)以上7个化学反应属于非氧化还原反应的是 (用编号①→⑦填写)
(3)写出反应①是 ;
(4)写出引发反应④的实验操作
写出该反应一种重要的工业用途
(5)反应⑤的化学方程式是 。
(5)写出用A与H作电极材料插入G溶液闭合电路后的正极反应式是 。
【解析】此题明显的突破口单质E和单质F在点燃或加热的条件下生成淡黄色的固体,马上知道是Na202,说明E、F一定为Na 和02。结合反应②条件是高温,马上就推出,E是02,F是Na(Na活泼不需要高温)。结合由B常温下为液态化合物,推出B为是水,D为H2,G为NaOH。反应⑤与NaOH反应产生氢气的单质中学阶段只有Al和Si,结合⑥电解推出H为Al,J为Al2O3。由反应②高温条件下产生氢气体的单质有Fe和C,结合反④高温条件得到Al2O3,那只有A是Fe。验证反应⑦符合条件。写出用Fe与Al作电极材料插入电解溶液NaOH ,总方程式是:2NaOH+2Al+2H2O =2NaAlO2+3H2↑,总方程式减去负极反应式2Al+8OH--6e-=2AlO2-+4H2O即为正极反应式:6H2O+6e-=6OH-+3H2↑。
【答案】(1) 四 Ⅷ(2分)
(2) ⑦(2分)
6.乙炔的应用:焊接和切割金属。
5.漂白粉的制备、漂白原理、失效原理;
4.铝热反应的原理、引发操作、应用;
3.围绕水开发试题:碱金属(Na、k)、碱土金属(Ca)等与水反应,碱金属(Na、k)、碱土金属(Ca)的过氧化物与水反应,卤素与水的反应(特别注意F2的特殊性),NO2与水反应,电石与水反应,铁与水蒸汽反应,碳与水蒸气反应等;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com