
14.铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
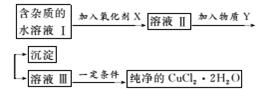
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH如表所示:
|
|
Fe3+ |
Fe2+ |
Cu2+ |
|
氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
|
氢氧化物完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题:
(1)加入氧化剂的目的是________。
(2)最适合作氧化剂X的是________。
A.K2Cr2O7 B.NaClO
C.H2O2 D.KMnO4
(3)加入的物质Y是________。
(4)若不用物质Y而是直接用碱能不能达到目的?________(填“能”或“不能”)。若能,不用回答;若不能,试解释原因_________________________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________(填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作?________________________________。
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是____________________________________。
解析:(1)由Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH知,当Fe2+开始沉淀时,Cu2+已经沉淀完全;而当Fe3+沉淀完全时,Cu2+尚未沉淀,所以除去Cu2+中的Fe2+时,需将Fe2+氧化成Fe3+后除去。
(2)加入的氧化剂能把Fe2+氧化成Fe3+,同时又不能引入新杂质,所以应选用H2O2。
(3)当除去Cu2+中的Fe3+时,可以利用Fe3+的水解:Fe3++3H2OFe(OH)3+3H+,所以加入的物质Y应具有以下条件:①能与H+反应使Fe3+的水解平衡向正反应方向移动,从而使Fe3+转化为Fe(OH)3沉淀而除去;②不能引入新杂质,满足该条件的物质Y可以是CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3。
(4)若直接加碱使Fe3+沉淀的同时,也能使Cu2+沉淀。
(5)若直接蒸发结晶将得不到CuCl2·2H2O晶体,因为在对CuCl2溶液蒸发的过程中,CuCl2水解产生的HCl从溶液中挥发出来,导致CuCl2水解平衡向正反应方向移动,最终得到CuO或Cu(OH)2,而得不到CuCl2·2H2O晶体。为了抑制CuCl2水解,应在HCl气流中加热蒸发结晶。
(6)在溶液Ⅱ中存在FeCl3、CuCl2的水解平衡,溶液呈酸性,加入的碳酸钙与水解产生的H+反应,导致c(H+)减小,水解平衡向正反应方向移动,直至反应完全,所以现象为碳酸钙溶解,同时产生气泡和沉淀。
答案:(1)将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离
(2)C
(3)CuO[Cu(OH)2、CuCO3、Cu2(OH)2CO3也可以]
(4)不能 加碱使Fe3+沉淀的同时也能使Cu2+沉淀
(5)不能 应在HCl气流中加热蒸发结晶
(6)碳酸钙溶解,产生气泡和沉淀

13.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是___________________________________
______________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2中的c(NH)________(填“等于”、“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图像。
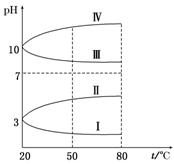
①其中符合0.1 mol/L NH4Al(SO4)2的pH随温度变化的曲线是________(填写字母),导致pH随温度变化的原因是_____________________________________________;
②20 ℃时,0.1 mol/L NH4Al(SO4)2中2c(SO)-c(NH)-3c(Al3+)=________。
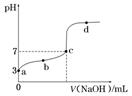
(4)室温时,向100 mL 0.1 mol/L NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
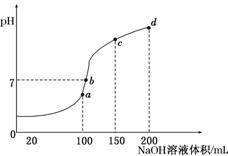
试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是___________________________________________。
解析:(1)Al3+水解生成的Al(OH)3胶体具有吸附性,即:Al3++3H2OAl(OH)3(胶体)+3H+,Al(OH)3吸附悬浮颗粒使其沉降。(2)NH4Al(SO4)2与NH4HSO4中的NH均发生水解,但NH4Al(SO4)2中Al3+水解呈酸性抑制NH水解,HSO电离出H+同样抑制NH水解,因为HSO电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH水解程度比NH4Al(SO4)2中的小。(3)NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ。根据电荷守恒,可以求出2c(SO)-c(NH)-3c(Al3+)=c(H+)-c(OH-)=10-3mol/L [c(OH-)太小,可忽略]。(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3·H2O,(NH4)2SO4可以促进水的电离,而NH3·H2O抑制水的电离,a点水的电离程度最大,b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3·H2O三种成分,a点时c(Na+)=c(SO),b点时c(Na+)>c(SO),根据N元素与S元素的关系,可以得出c(SO)>c(NH),故c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)。
答案:(1)Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2OAl(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水
(2)小于 (3)①Ⅰ NH4Al(SO4)2水解,溶液呈酸性,升高温度使其水解程度增大,pH减小
②10-3mol/L (4)a点 c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)
12. CO2可转化成有机物实现碳循环:CO2H2,CH3OHHCOOH…
(1)用离子方程式表示HCOONa溶液呈碱性的原因_______________________,写出该反应的平衡常数(Kh)表达式:Kh=________________,升高温度,Kh________(填“增大”、“减小”或“不变”)。
(2)常温下,将0.2 mol/L的HCOOH和0.1 mol/L的NaOH溶液等体积混合,所得溶液的pH<7,说明HCOOH的电离程度________HCOONa的水解程度(填“大于”或“小于”)。该混合溶液中离子浓度由大到小的顺序是_____________________________________。
解析:(2)溶液混合后为浓度相等的HCOOH和HCOONa,溶液显酸性,所以HCOOH HCOO-+H+的程度大于HCOO-+H2O
HCOO-+H+的程度大于HCOO-+H2O HCOOH+OH-,依据电荷守恒c(HCOO-)+c(OH-)=c(H+)+c(Na+),可比较离子浓度大小。
HCOOH+OH-,依据电荷守恒c(HCOO-)+c(OH-)=c(H+)+c(Na+),可比较离子浓度大小。
答案:(1)HCOO-+H2O HCOOH+OH-
HCOOH+OH-
增大
(2)大于 c(HCOO-)>c(Na+)>c(H+)>c(OH-)
二、非选择题
11.现有浓度均为0.1 mol/L的五种电解质溶液:
A.Na2CO3 B.NaHCO3 C.NaAlO2 D.CH3COONa E.NaOH
(1)这五种溶液中水的电离程度最大的是________(填编号)。
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是________(填编号)。
(3)将上述A、B、C、D四种溶液两两混合时,有一对溶液相互间能够发生反应,写出该反应的离子方程式:__________________________________________________。
(4)将CO2通入A溶液中恰好呈中性,溶液中2c(CO)+c(HCO)=________mol/L (设反应前后溶液体积不变)。
解析:五种物质中有四种可水解的盐和一种强碱。
(1)酸性:CH3COOH>H2CO3>HCO>Al(OH)3,根据越弱越水解,水解程度最大的NaAlO2溶液中水的电离程度最大。(2)稀释过程中,可水解的盐水解平衡右移,溶液的pH变化程度相对较小,NaOH完全电离,溶液的pH变化最大。(3)HCO的酸性大于Al(OH)3,故NaAlO2能与NaHCO3反应生成Al(OH)3沉淀。(4)由电荷守恒得:c(Na+)+ c(H+)=2c(CO)+c(HCO)+c(OH-),因溶液呈中性:c(H+)=c(OH-),所以2c(CO)+c(HCO)=c(Na+)=0.2 mol/L。
答案:(1)C (2)E
(3)HCO+AlO+H2O===Al(OH)3↓+CO
(4)0.2
10.下列溶液中离子浓度关系的表示正确的是( )
A.NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO)+c(HCO)
B.常温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)+c(CH3COO-)
C.0.1 mol/L的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH)>c(OH-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-)
解析:选D A中电荷不守恒;B中pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后乙酸过量,溶液显酸性,所以c(H+)>c(OH-);C中应该为c(Cl-)>c(NH)>c(H+)>c(OH-);D项符合物料守恒。
9.下列说法正确的是( )
A.常温下,pH=3的HX(一元酸)溶液与pH=11的YOH(一元碱)溶液等体积混合,所得溶液的pH一定大于或等于7
B.在相同温度下,浓度均为0.1 mol/L的(NH4)2Fe(SO4)2和(NH4)2SO4溶液中,c(NH)相同
C.在pH<7的CH3COOH和CH3COONa的混合液中,c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.0.4 mol/L盐酸与0.1 mol/L NaAlO2溶液等体积混合,所得溶液中:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-)
解析:选D A项,若HX为强酸,YOH为强碱,则pH=7;若HX为弱酸,YOH为强碱,则pH<7;若HX为强酸,YOH为弱碱,则pH>7,错误;B项,由于Fe2+的水解会抑制NH的水解,故(NH4)2Fe(SO4)2溶液中的c(NH)比(NH4)2SO4中的大,错误;C项,根据关系式可知c(Na+)+c(H+)>c(CH3COO-)+c(OH-),而此关系式不符合电荷守恒,错误;D项,所得溶液为等浓度的AlCl3与NaCl的混合溶液,正确。
8.
(2014·济南模拟)已知常温下CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是( )
A.a点表示的溶液中c(CH3COO-)略小于10-3mol/L
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中 均等于K
解析:选C A项,a点表示的溶液中c(H+)=10-3 mol/L,由于溶液中有少量的OH-,所以c(CH3COO-)略小于10-3 mol/L,正确;B项,b点表示的溶液中c(H+)>c(OH-),所以c(CH3COO-)>c(Na+),正确;C项,溶液呈中性,NaOH稍过量,错误;D项,温度不变,平衡常数不变,b、d点表示的溶液中 均等于K,正确。
7.(2014·台州模拟)已知在常温下测得浓度均为0.1 mol/L的下列三种溶液的pH:
|
溶质 |
NaHCO3 |
Na2CO3 |
NaCN |
|
pH |
9.7 |
11.6 |
11.1 |
下列说法中正确的是( )
A.阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3
B.相同条件下的酸性:H2CO3<HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度,减小
解析:选C 阳离子均为Na+和H+,Na2CO3溶液中Na+浓度是其他两种溶液的两倍,阳离子浓度最大,NaCN溶液和NaHCO3 溶液中Na+浓度相等,NaCN溶液中H+浓度小于NaHCO3 溶液,故阳离子浓度大小顺序为Na2CO3>NaHCO3>NaCN,A错误;HCO的水解能力小于CN-,故酸性:H2CO3>HCN,B错误;升高Na2CO3溶液的温度,促进其水解,增大,D错误。
6.(2013·三门峡模拟)有一种酸式盐AHB,它的水溶液呈弱碱性。则以下说法:
①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB-的水解程度;
④该盐溶液的电离方程式一般写成:AHB A++HB-,HB-
A++HB-,HB- H++B2-。
H++B2-。
其中错误选项的组合是( )
A.①② B.③④
C.②③ D.①④
解析:选B 酸式盐AHB的水溶液呈弱碱性,说明AOH的碱性相对较强,H2B的酸性相对较弱,且HB-的电离程度小于HB-的水解程度,相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度。AHB溶液的电离方程式一般写成AHB===A++HB-,HB-H++B2-。
5.下面提到的问题中,与盐的水解有关的是( )
①明矾和FeCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③实验室配制AlCl3溶液时,应先把它溶解在盐酸中,而后加水稀释
④NH4Cl溶液可作焊接中的除锈剂
⑤实验室盛放Na2SiO3溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
⑦在NH4Cl或AlCl3溶液中加入金属镁会生成氢气
⑧草木灰与铵态氮肥不能混合施用
⑨加热蒸干AlCl3溶液得到Al(OH)3固体
A.①④⑦ B.②⑤⑧
C.③⑥⑨ D.全部
解析:选D ①Al3+和Fe3+水解产生Al(OH)3胶体和Fe(OH)3胶体,吸附水中的悬浮杂质。②加盐酸可抑制FeCl3水解。③AlCl3溶解在盐酸中可抑制Al3+的水解。④NH水解产生的H+与铁锈反应。⑤Na2SiO3溶液水解显碱性,可腐蚀玻璃。⑥Al3+与HCO发生水解相互促进的反应,产生大量泡沫。⑦NH和Al3+水解产生的H+与Mg反应。⑧NH水解显酸性,草木灰水解显碱性,二者水解相互促进会使NH3逸出,降低肥效。⑨AlCl3溶液中存在水解平衡:AlCl3+3H2OAl(OH)3+3HCl,加热时,HCl挥发使平衡不断右移,最终得到Al(OH)3固体(如果灼烧会得到Al2O3固体)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com