
1.原子序数依次递增的A、B、C、D、E是周期表中前30号元素。已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个。请回答下列问题:
(1)B在周期表中的位置是__________,该主族元素的气态氢化物中,沸点最低的是________(填化学式)。
(2)根据等电子原理分析,BC中B原子的轨道杂化类型是________。
(3)五种元素中,电负性最大与最小的两种非金属元素形成的化合物在常温下是晶体,其晶体类型是________。
(4)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5、…,推测D元素的电离能突增应出现在第________________________________________________________________________
电离能。
(5)A的一种相对分子质量为28的氢化物,其分子中σ键与π键的个数之比为________。
(6)E的基态原子有________种形状不同的原子轨道;E2+的价电子排布式为__________;如图________(填“甲”、“乙”或“丙”)表示的是E晶体中微粒的堆积方式。

解析:根据元素的结构及有关性质可知,A、B、C、D、E五种元素分别是C、N、O、Si、Cu。
(1)氮元素的质子数是7,位于第二周期第ⅤA族;氨气分子存在氢键,所以其熔沸点是同主族元素的氢化物中最高的,而最低的是PH3。
(2)价电子数与原子数分别都相等的是等电子体,所以与NO互为等电子体的是CO2。由于CO2是直线形结构,碳原子是sp杂化,所以NO中氮原子也是sp杂化。
(3)电负性最大与最小的两种非金属元素分别是O和Si,形成的氧化物是SiO2,属于原子晶体。
(4)硅元素的最外层电子数是4个,最高价是+4价,所以硅元素的电离能突增应出现在第五电离能。
(5)碳元素的一种相对分子质量为28的氢化物是乙烯,分子中含有碳碳双键,而双键是由1个σ键与1个π键构成的,单键都是σ键,所以分子中σ键与π键的个数之比为5∶1。
(6)铜原子的基态原子有s、p、d 3种形状不同的原子轨道;根据构造原理可知,Cu2+的价电子排布式为3d9;根据晶胞可知,甲是体心立方堆积,乙是六方最密堆积,丙是面心立方最密堆积,所以选丙。
答案:(1)第二周期第ⅤA族 PH3
(2)sp (3)原子晶体
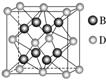
12.有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。
请回答下列问题:
(1)E元素原子基态时的电子排布式为________________________________________________________________________。
(2)A2F分子中F原子的杂化类型是________,F的氧化物FO3分子空间构型为________。
(3)CA3极易溶于水,其原因主要是________________________________________,
试判断CA3溶于水后,形成CA3·H2O的合理结构:_______(填字母代号),推理依据是________________________________________________________________________________________________________________________________________________。

(4)从图中可以看出,D跟B形成的离子化合物的化学式为________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________________________(写出表达式即可)。
解析:由题意可知A、B、C分别为H、F、N,故推出F是S,由题意推出E是Cu,由晶胞的结构用均摊法计算出一个晶胞中含有8个F-,同时含有4个D离子,故可判断D是第四周期+2价的金属元素,故D是钙元素。NH3极易溶于水的原因是能与水分子间形成氢键,根据氢键的表示方法可知(b)是合理的;根据密度ρ=m/V进行计算,应注意一个晶胞中含有4个CaF2。
答案:(1)1s22s22p63s23p63d104s1或[Ar]3d104s1
(2)sp3 平面正三角形
(3)与水分子间形成氢键 (b) 一水合氨电离产生铵根离子和氢氧根离子
(4)CaF2

11.金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为________________________________________________________________________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”)。
(3)NiO晶胞中Ni和O的配位数分别为________、________。
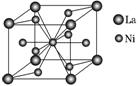
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,该合金的化学式为________。
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示。
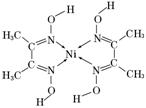
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是____________,氮镍之间形成的化学键是____________;
②该结构中,氧氢之间除共价键外还可存在________;
③该结构中,碳原子的杂化轨道类型有____________。
解析:(1)Ni是28号元素,其核外电子排布式为:
1s22s22p63s23p63d84s2。
(2)因为两者都是离子晶体,故离子半径越小,离子键越强,物质的熔、沸点越高,故熔点NiO>FeO。
(3)由于NiO的晶体结构类型与氯化钠的相同,故Ni和O的配位数均为6。
(4)由图示可以看出,La原子均在晶体的8个顶点上,而Ni原子有1个在中心,另外的8个在面上,故La原子个数=8×=1,Ni原子个数=1+8×=5,故化学式为LaNi5。
(5)①由于碳氮之间是双键,故既有σ键,又有π键。氮镍之间形成的化学键是配位键;②由于氧的电负性很大,故氧氢之间除共价键外还可能存在氢键;③由结构中碳原子的成键特点可以看出,类似于乙烯分子中的碳原子,故发生的是sp2杂化,同时分子中含有甲基,故这部分碳原子发生的是sp3杂化。
答案:(1)[Ar]3d84s2或1s22s22p63s23p63d84s2
(2)> (3)6 6 (4)LaNi5 (5)①σ键、π键 配位键
②氢键 ③sp2杂化、sp3杂化
10.(2014·宁波模拟)纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物。回答下列问题:
(1)写出基态Cu+的核外电子排布式:________________;C、N、O三种元素的第一电离能由大到小的顺序是:__________________________________。
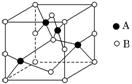
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为________________________________________________________________________。
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀。该深蓝色沉淀中的NH3通过________键与中心离子Cu2+结合;NH3分子中N原子的杂化方式是________;与NH3分子互为等电子体的一种微粒是________(任写一种)。
(4)CuO的熔点比CuCl的熔点________(填“高”或“低”)。
(5)CuO在高温下易转化为Cu2O,其原因是__________________________________。
解析:(1)铜等过渡金属原子失电子时,先失最外层电子,故基态Cu+的核外电子排布式是1s22s22p63s23p63d10或[Ar]3d10;C、N、O三种元素的第一电离能由大到小的顺序是N、O、C。(2)从晶胞示意图分析,含A、B两种原子的数目之比为 1∶1,故该铜的氧化物的化学式为CuO。(3)[Cu(NH3)4]SO4·H2O中NH3通过配位键与中心离子Cu2+结合;NH3分子中N原子的杂化方式是sp3;与NH3分子互为等电子体的微粒有H3O+等。(4)氧元素的电负性比氯元素的大,与铜形成的化学键中离子键强度较大,故CuO的熔点比CuCl的熔点高。(5)CuO高温易转化为Cu2O的原因是Cu2O中Cu的d轨道为全充满状态,较稳定。
答案:(1)1s22s22p63s23p63d10 N、O、C
(2)CuO (3)配位 sp3 H3O+(或其他合理答案)
(4)高 (5)Cu2O中Cu的d轨道为全充满状态,较稳定
二、非选择题
9.(1)氯酸钾熔化,粒子间克服了________的作用力;二氧化硅熔化,粒子间克服了________的作用力;碘的升华,粒子间克服了________的作用力。三种晶体的熔点由高到低的顺序是________________。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__________(填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有________,由非极性键形成的非极性分子有________,能形成分子晶体的物质是________,含有氢键的晶体的化学式是________,属于离子晶体的是________,属于原子晶体的是________,五种物质的熔点由高到低的顺序是_________________________________________________________。
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500 ℃
试推断它们的晶体类型:
A________,B________,C________,D________。
(5)如图所示A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A________,B________,C________,D________。
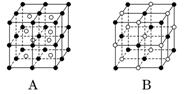
解析:(1)氯酸钾是离子晶体,熔化离子晶体时需要克服离子键的作用力;二氧化硅是原子晶体,熔化原子晶体时需要克服共价键的作用力;碘为分子晶体,熔化分子晶体时需克服的是分子间的作用力。由于原子晶体是由共价键形成的空间网状结构的晶体,所以原子晶体的熔点最高;其次是离子晶体;由于分子间作用力与化学键相比较要小得多,所以碘的熔点最低。
(2)先把六种晶体分类。原子晶体:④、⑥;离子晶体:②;金属晶体:③;分子晶体:①、⑤。由于C原子半径小于Si原子半径,所以金刚石的熔点高于晶体硅;CO2和CS2同属于分子晶体,其熔点与相对分子质量成正比,故CS2熔点高于CO2;Na在通常状况下是固态,而CS2是液态,CO2是气态,所以Na的熔点高于CS2和CO2;Na在水中即熔化成小球,说明它的熔点较NaCl低。
答案:(1)离子键 共价键 分子间 SiO2>KClO3>I2
(2)①⑤③②④⑥ (3)CO2 H2 H2、CO2、HF HF (NH4)2SO4 SiC SiC>(NH4)2SO4>HF>CO2>H2
(4)金属晶体 分子晶体 离子晶体 原子晶体
(5)氯化铯 氯化钠 二氧化硅 金刚石
8.钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )
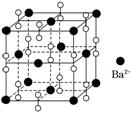 A.该晶体属于离子晶体
A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与NaCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个
解析:选B 由晶胞结构及“均摊法”计算:一个晶胞中含Ba2+:8×1/8+6×1/2=4个,含O:12×1/4+1=4个,故晶体的化学式是BaO2,其它选项可结合NaCl 晶胞知识做出判断。
7.(双选)(2014·广州高三检测)下列数据是对应物质的熔点,有关的判断错误的是( )
|
Na2O |
Na |
AlF3 |
AlCl3 |
Al2O3 |
BCl3 |
CO2 |
SiO2 |
|
920 ℃ |
97.8 ℃ |
1 291 ℃ |
190 ℃ |
2 073 ℃ |
-107 ℃ |
-57 ℃ |
1 723 ℃ |
A.只要含有金属阳离子的晶体就一定是离子晶体
B.在共价化合物分子中各原子都形成8电子结构
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
解析:选A、B A项,含有金属阳离子的晶体可能是金属晶体;B项, BCl3中B为6电子结构;C项,CO2为分子晶体,SiO2为原子晶体; D项,金属Na的熔点比分子晶体AlCl3的低。
6.根据如表所示几种物质的熔点和沸点数据,判断下列有关说法中,错误的是( )
|
物质 |
熔点/℃ |
沸点/℃ |
|
NaCl |
810 |
1 465 |
|
MgCl2 |
710 |
1 418 |
|
AlCl3 |
190 |
182.7 |
|
SiCl4 |
-68 |
57 |
|
单质B |
2 300 |
2 500 |
注:AlCl3熔点在2.02×105 Pa条件下测定。
A.SiCl4是分子晶体
B.单质B是原子晶体
C.AlCl3加热能升华
D.MgCl2所含离子键的强度比NaCl大
解析:选D 三类不同的晶体由于形成晶体的粒子和粒子间的作用力不同,因而表现出不同的性质。原子晶体具有高的熔、沸点,硬度大、不能导电;而离子晶体也具有较高的熔、沸点,较大的硬度,在溶液中或熔融状态下能导电;分子晶体熔、沸点低,硬度小,不导电,熔化时无化学键断裂,据这些性质可确定晶体类型。根据上述性质特点及表中数据进行分析,NaCl的熔、沸点均比MgCl2高,所以NaCl晶体中的离子键应比MgCl2的强,故D错误。
5.下列各物质中,按熔点由高到低的顺序排列正确的是( )
A.CH4>SiH4>GeH4>SnH4
B.KCl>NaCl>MgCl2>MgO
C.Rb>K>Na>Li
D.金刚石>Si>钠
解析:选D 晶体熔点的高低取决于构成该晶体的结构粒子间作用力的大小。A项,物质均为结构相似的分子晶体,其熔点取决于分子间作用力的大小,一般来说,结构相似的分子晶体,相对分子质量越大者分子间作用力也越大,熔点也逐渐升高;B项,物质均为离子晶体,离子晶体熔点高低取决于离子键键能的大小,一般来说,离子的半径越小,电荷越多,离子键的键能就越强,熔点也越高;C项,物质均为同主族的金属晶体,其熔点高低取决于金属键的强弱,而金属键键能与金属原子半径成反比,与价电子数成正比,碱金属原子半径依Li~Cs的顺序增大,价电子数相同,故熔点应是Li最高,Cs最低;D项,原子晶体的熔点取决于共价键的键能,后者则与键长成反比, 金刚石C—C键的键长更短些,所以金刚石的熔点比硅高,原子晶体的熔点一般比金属晶体的熔点高。
4.下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2
④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A.①②③ B.④⑤⑥ C.③④⑥ D.①③⑤
解析:选C 本题中属于分子晶体的有SO3、HCl、CO2、SO2、晶体氖、晶体氮、硫黄、碘,属于原子晶体的有SiO2、晶体硼、晶体硅、金刚石,但晶体氖是由稀有气体分子构成的,稀有气体分子间不存在化学键。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com